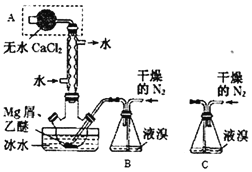
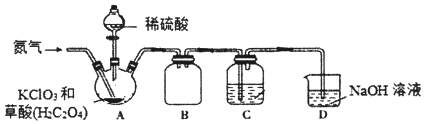
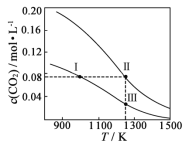
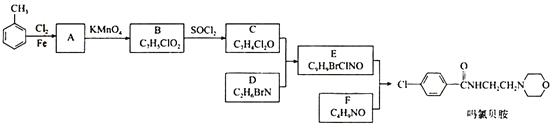
题目内容
【题目】第三代太阳能电池就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)晶体硅中Si原子的杂化方式是___,基态Ga原子核外电子排布式为___。
(2)向硫酸铜溶液中逐滴滴加浓氨水,先出现蓝色絮状沉淀,后沉淀逐渐溶解得到[Cu(NH3)4]SO4的深蓝色透明溶液。
①NH3极易溶于水,除因为NH3与H2O都是极性分子外,还因为____。
②在[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键称为___,提供孤电子对的成键原子是___。
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___。
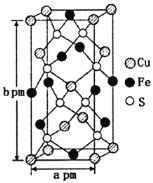
(3)某含铜化合物的晶胞如图所示,晶胞上下底面为正方形,侧面与底面垂直。则晶胞中每个Cu原子与____个S原子相连,含铜化合物的化学式为____。设NA为阿伏加德罗常数的值,则该晶胞的密度为___gcm3(用含a、b、NA的代数式表示)。
【答案】sp3 1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1 NH3与H2O之间可形成分子间氢键,NH3与H2O发生反应 配位键 N 平面正方形 4 CuFeS2 ![]()
【解析】
(1)根据晶体硅中每个Si原子与周围的4个硅原子形成正四面体,向空间延伸的立体网状结构判断;Ga是31号元素,根据能量最低原理书写核外电子排布式;
(2)①氨气分子与水分子之间形成氢键,且氨气能与水反应;
②Cu2+含有空轨道,NH3中N原子含有孤电子对;
③[Cu(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种不同结构的产物,[Cu(NH3)4]2+的空间构型为平面正方形;
(3)根据均摊法计算晶胞中各原子数目,确定化学式,进而计算晶胞质量,再根据![]() 计算晶胞密度。
计算晶胞密度。
(1)因晶体硅中每个Si原子与周围的4个硅原子形成正四面体,向空间延伸的立体网状结构,所以晶体硅中Si原子的杂化方式为sp3杂化。Ga位于周期表中第4周期第ⅢA族,则基态Ga原子的核外电子排布式为1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1,故答案为:sp3;1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1;
(2)①NH3极易溶于水,除因为它们都是极性分子外,还因为:NH3与H2O之间可形成分子间氢键,NH3与H2O发生反应,故答案为:NH3与H2O之间可形成分子间氢键,NH3与H2O发生反应;
②Cu2+含有空轨道,NH3中N原子含有孤电子对,二者形成配位键,故答案为:配位键;N;
③[Cu(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种不同结构的产物,[Cu(NH3)4]2+的空间构型为平面正方形,故答案为:平面正方形;
(3)晶胞中D(S)原子位于晶胞内部,原子数目为8个,E(Fe)原子6个位于面上、4个位于棱上,E(Fe)原子数目=6×![]() +4×
+4×![]() =4,F(Cu)原子位于4个位于面上、1个内部、8个顶点上,原子数目=4×
=4,F(Cu)原子位于4个位于面上、1个内部、8个顶点上,原子数目=4×![]() +1+8×
+1+8×![]() =4,晶体中Cu、Fe、S原子数目之比=4:4:8=1:1:2,故该晶体化学式为:CuFeS2,
=4,晶体中Cu、Fe、S原子数目之比=4:4:8=1:1:2,故该晶体化学式为:CuFeS2,
晶胞质量m=![]() ×4g,晶胞体积V=(a×10-10cm)2×b×10-10cm,
×4g,晶胞体积V=(a×10-10cm)2×b×10-10cm,
晶体密度ρ=(![]() ×4g)÷[(a×10-10cm)2×b×10-10cm]=
×4g)÷[(a×10-10cm)2×b×10-10cm]=![]() gcm3,
gcm3,
故答案为:4;CuFeS2;![]() 。
。

 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣(主要成分为ZnO,还含有铁、铝、铜的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化锌的工艺流程如图所示:

已知:相关金属离子c(Mn+)=0.1mol/L生成氢氧化物沉淀的pH如下表所示:
Fe3+ | Fe2+ | Al3+ | Mn2+ | Zn2+ | Cu2+ | Cd2+ | |
开始沉淀 | 1.5 | 6.3 | 3.4 | 8.1 | 6.2 | 6.0 | 7.4 |
沉淀完全 | 2.8 | 8.3 | 4.7 | 10.1 | 8.2 | 8.0 | 9.4 |
回答下列问题:
(1)为保证锌渣酸浸的充分,先保持酸过量,且c(H+)=0.5mol/L左右。写出一种加快锌渣浸出的方法:_______________
(2)为调节溶液的pH,则试剂X为__________________(填化学式),且调节溶液pH的范围是____________
(3)除杂时加入高锰酸钾的作用是_______________,发生反应的离子方程式为_____________
(4)“过滤”所得滤渣的主要成分是_____________________(填化学式)
(5)写出“碳化合成”的化学方程式:_____________________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_____________________