题目内容
【题目】常温下,向100 mL 0.01 molL﹣1 HA溶液中逐滴加入0.02 molL﹣1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是
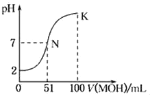
A. HA为一元强酸,MOH为一元弱碱
B. N点溶液中离子浓度大小关系为:c(M+)=c(A﹣)>c(H+)=c(OH﹣)
C. N点水的电离程度大于K点水的电离程度
D. N→K之间曲线上任意一点都有c(M+) >c(OH﹣)>c(A﹣)>c(H+)
【答案】D
【解析】A,没有滴入MOH溶液时0.01mol/LHA溶液的pH=2,HA为一元强酸,N点为向100mL0.01mol/L的HA溶液中加入51mL0.02mol/LMOH溶液,溶液由MA和过量的MOH混合而成,溶液的pH=7,则MA溶液呈酸性,MOH为一元弱碱,A项正确;B,N点溶液中的电荷守恒为c(M+)+c(H+)=c(A-)+c(OH-),溶液的pH=7,则c(H+)=c(OH-),代入电荷守恒式得c(M+)=c(A-)![]() c(H+)=c(OH-),B项正确;C,开始HA电离出H+抑制水的电离,随着MOH的滴入,HA与MOH发生反应生成MA,溶液中c(H+)减小,对水的抑制程度减小,同时M+的水解促进水的电离,随着MOH的滴入,水的电离程度逐渐增大,加入50mLMOH时HA与MOH恰好完全反应,水的电离程度最大,继续滴入MOH,MOH电离出OH-抑制水的电离,水的电离程度又逐渐减小,N点、K点加入MOH溶液的体积:50mL
c(H+)=c(OH-),B项正确;C,开始HA电离出H+抑制水的电离,随着MOH的滴入,HA与MOH发生反应生成MA,溶液中c(H+)减小,对水的抑制程度减小,同时M+的水解促进水的电离,随着MOH的滴入,水的电离程度逐渐增大,加入50mLMOH时HA与MOH恰好完全反应,水的电离程度最大,继续滴入MOH,MOH电离出OH-抑制水的电离,水的电离程度又逐渐减小,N点、K点加入MOH溶液的体积:50mL![]() 51mL(N点)
51mL(N点)![]() 100mL(K点),N点水的电离程度大于K点水的电离程度,C项正确;D,K点加入100mLMOH溶液,HA与MOH反应得到等物质的量浓度的MA和MOH的混合液,MA完全电离,MOH部分电离,溶液呈碱性,MOH的电离程度大于M+的水解程度,K点溶液中离子浓度由大到小的顺序为c(M+)
100mL(K点),N点水的电离程度大于K点水的电离程度,C项正确;D,K点加入100mLMOH溶液,HA与MOH反应得到等物质的量浓度的MA和MOH的混合液,MA完全电离,MOH部分电离,溶液呈碱性,MOH的电离程度大于M+的水解程度,K点溶液中离子浓度由大到小的顺序为c(M+)![]() c(A-)
c(A-)![]() c(OH-)
c(OH-)![]() c(H+),N→K之间任意一点溶液中都存在c(MA)
c(H+),N→K之间任意一点溶液中都存在c(MA)![]() c(MOH),溶液呈碱性,都有c(M+)
c(MOH),溶液呈碱性,都有c(M+)![]() c(A-)
c(A-)![]() c(OH-)
c(OH-)![]() c(H+),D项错误;答案选D。
c(H+),D项错误;答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案