题目内容
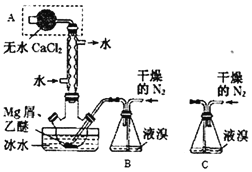
【题目】利用太阳能光伏电池电解水可交替制得高纯H2和O2,工作示意图如图所示。下列说法错误的是( )
A.制H2时,连接K1;制O2时,连接K2
B.产生H2的电极反应式是2H++2e-=H2↑
C.制O2时电极3发生的电极反应为NiOOH+H2O+e-=Ni(OH)2+OH-
D.通过控制开关交替连接K1或K2,可以使电极3循环使用
【答案】B
【解析】
A.电解水生成氢气和氧气,氧气在阳极生成,氢气在阴极生成,制H2时,开关应连接K1,氢气在电极1(阴极)放出,制O2时,开关应连接K2,氧气在电极2(阳极)放出,故A正确;
B.开关应连接K1,氢气在电极1(阴极)放出,电极反应式为2H2O+2e-=H2↑+2OH-,故B错误;
C.制O2时,电极3连接K2时,电极3为阴极,NiOOH→Ni(OH)2,对应的电极反应方程式为NiOOH+H2O+e-=Ni(OH)2+OH-,故C正确;
D.电极3可分别连接K1或K2,分别发生氧化、还原反应,实现NiOOHNi(OH)2的转化,且可循环使用,故D正确;
故选:B。

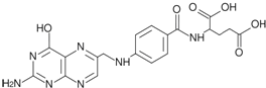
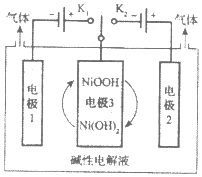
【题目】合成氨对化学工业和国防工业具有重要意义。
(1)根据图1请写出合成氨的热化学方程式______![]() 热量用
热量用![]() 、
、![]() 或
或![]() 表示
表示![]() 。
。
(2)向合成塔中按物质的量之比l:4充入![]() 、
、![]() 进行氨的合成,图2为
进行氨的合成,图2为![]() 时平衡混合物中氨气的体积分数与压强
时平衡混合物中氨气的体积分数与压强![]() 的关系图。
的关系图。
①图2中氨气的体积分数为![]() 时,
时,![]() 的转化率为______。
的转化率为______。
②图3中![]() ,则温度为
,则温度为![]() 时对应的曲线是______
时对应的曲线是______![]() 填“a”或“b”
填“a”或“b”![]() 。
。
(3)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为![]() ,一定温度下,在体积为2L的恒容容器中发生上述反应,各物质的物质的量变化如表:
,一定温度下,在体积为2L的恒容容器中发生上述反应,各物质的物质的量变化如表:
时间 |
|
|
|
|
0 |
|
| 0 | 0 |
5 |
|
|
|
|
7 |
|
|
|
|
10 |
|
|
|
|
①分析表中数据,判断5min时反应是否处于平衡状态?______![]() 填“是”或“否”
填“是”或“否”![]() ,前5min反应的平均反应速率
,前5min反应的平均反应速率![]() ______。
______。
②在相同实验条件下,若改为加入![]() ,若要求平衡后
,若要求平衡后![]() 在反应混合气中质量分数不变,则还需加入的物质及其物质的量为______。
在反应混合气中质量分数不变,则还需加入的物质及其物质的量为______。
③反应在![]() 内,CO的物质的量减少的原因可能是______
内,CO的物质的量减少的原因可能是______![]() 填字母
填字母![]() 。
。
![]() 减少
减少![]() 的物质的量
的物质的量 ![]() 降低温度
降低温度 ![]() 升高温度
升高温度 ![]() 充入
充入![]()
④下列方法中可以证明上述已达平衡状态的是______。
![]() 单位时间内生成
单位时间内生成![]() 的同时生成
的同时生成![]()
b.容器内压强不再变化
![]() 混合气体密度不再变化
混合气体密度不再变化
![]() 混合气体的平均相对分子质量不再变化
混合气体的平均相对分子质量不再变化
![]() 的质量分数不再变化
的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值![]() 如表:
如表:
气化反应式 | lgK | ||
700K | 900K | 1200K | |
|
|
|
|
|
|
|
|
则反应![]() 在900K时,该反应平衡常数的对数值
在900K时,该反应平衡常数的对数值![]() ______。
______。
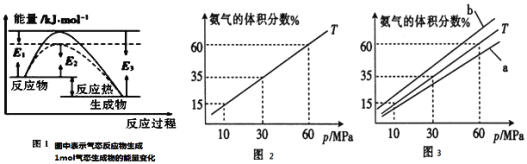
【题目】肉桂酸是一种香料,具有很好的保香作用,通常作为配香原料,可使主香料的香气更加清香.实验室制备肉桂酸的化学方程式为:
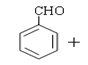 (CH3CO)2
(CH3CO)2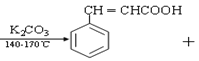 CH3COOH
CH3COOH
主要试剂及其物理性质
名称 | 分子量 | 性状 | 密度 | 熔点 | 沸点 | 溶解度:克 | ||
水 | 醇 | 醚 | ||||||
苯甲醛 | 106 | 无色液体 |
|
|
|
| 互溶 | 互溶 |
乙酸酐 | 102 | 无色液体 |
|
|
| 12 | 溶 | 不溶 |
肉桂酸 | 148 | 无色结晶 |
|
| 300 |
| 24 | 溶 |
密度:常压,![]() 测定主要实验步骤和装置如下:
测定主要实验步骤和装置如下:
Ⅰ![]() 合成:按图1连接仪器,加入
合成:按图1连接仪器,加入![]() 苯甲醛、
苯甲醛、![]() 乙酸酐和
乙酸酐和![]() 无水碳酸钾.在
无水碳酸钾.在![]() ,将此混合物回流45min.
,将此混合物回流45min.
Ⅱ![]() 分离与提纯:
分离与提纯:![]() 将上述合成的产品冷却后边搅拌边加入40ml水浸泡5分钟,并用水蒸气蒸馏,从混合物中除去未反应的苯甲醛,得到粗产品;
将上述合成的产品冷却后边搅拌边加入40ml水浸泡5分钟,并用水蒸气蒸馏,从混合物中除去未反应的苯甲醛,得到粗产品;![]() 将上述粗产品冷却后加入40ml
将上述粗产品冷却后加入40ml![]() 的氢氧化钠水溶液,再加90ml水,加热活性炭脱色,趁热过滤、冷却;
的氢氧化钠水溶液,再加90ml水,加热活性炭脱色,趁热过滤、冷却;![]() 将1:1的盐酸在搅拌下加入到肉桂酸盐溶液中,至溶液呈酸性,经冷却、减压过滤、洗涤、干燥等操作得到较纯净的肉桂酸;
将1:1的盐酸在搅拌下加入到肉桂酸盐溶液中,至溶液呈酸性,经冷却、减压过滤、洗涤、干燥等操作得到较纯净的肉桂酸;
水蒸气蒸馏:使有机物可在较低的温度下从混合物中蒸馏出来,可以避免在常压下蒸馏时所造成的损失,提高分离提纯的效率.同时在操作和装置方面也较减压蒸馏简便一些,所以水蒸气蒸馏可以应用于分离和提纯有机物.回答下列问题:
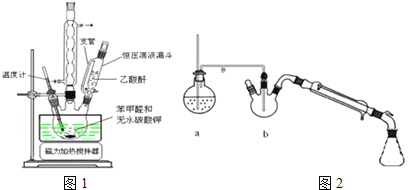
(1)合成肉桂酸的实验需在无水条件下进行,实验前仪器必须干燥的原因是 ______ ![]() 实验中为控制温度在
实验中为控制温度在![]() 需在 ______ 中加热.
需在 ______ 中加热.
A.水![]() 甘油
甘油![]() 沸点
沸点![]()
![]() 砂子
砂子![]() 植物油
植物油![]() 沸点
沸点![]()
(2)图2中装置a的作用是 ______ ,装置b中长玻璃导管要伸入混合物中的原因是 ______ ,水蒸气蒸馏后产品在 ______ ![]() 填仪器名称
填仪器名称![]() ;
;
(3)趁热过滤的目的 ______ ;
(4)加入1:1的盐酸的目的是 ______ ,析出肉桂酸晶体过滤后洗涤,洗涤剂是 ______ ;
(5)5.3g苯甲醛、![]() 乙酸酐和
乙酸酐和![]() 无水碳酸钾充分反应得到肉桂酸实际
无水碳酸钾充分反应得到肉桂酸实际![]() ,则产率是 ______
,则产率是 ______ ![]() 保留3位有效数字
保留3位有效数字![]() .
.