题目内容
【题目】X、Y、Z、W有如图所示的转化关系(反应条件和部分其它反应物省略) 则X、Y、Z可能是( )

①Na、Na2O、Na2O2 ②AlCl3、Al(OH)3、 NaA1O2
③ Fe、 FeCl2、FeCl3 ④NaOH、Na2CO3 、NaHCO3 ⑤C、CO、CO2
A.①②④⑤B.①③⑤C.②④D.①②③④⑤
【答案】A
【解析】
图中X可连续与W发生反应,X如为单质,可为C、Na等对应的单质,也可为化合物,如AlCl3、NaOH等,以此解答该题。
①若X为Na、W为O2,则Y为Na2O,Z为Na2O2,O2与Na反应在加热的时候生成Na2O2,故①正确;
②若X为AlCl3,W为NaOH,则Y为Al(OH)3,Z为NaAlO2,过量NaOH与AlCl3反应生成NaAlO2,故②正确;
③若X为Fe、W为Cl2,则Fe与Cl2只生成FeCl3,故③错误;
④若X为NaOH、W为CO2,则Y为Na2CO3,Z为NaHCO3,过量CO2与NaOH反应生成NaHCO3,故④正确;
⑤若X为C、W为O2,则Y为CO,Z为CO2,过量O2与C反应生成CO2,故⑤正确;
如上分析①②④⑤正确,答案为A。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】实验室从含碘废液(含有H2O 、CCl4、I2、I-等)中回收碘,操作过程如下:
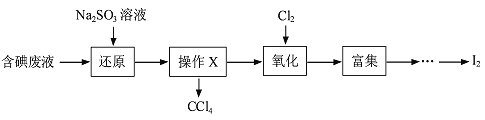
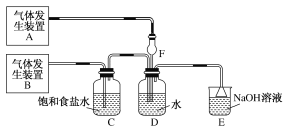
(1)向废液中加入Na2SO3溶液,发生“还原”反应的离子方程式为____________。
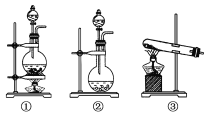
(2)“氧化”操作在三颈烧瓶中进行(如图一),将溶液用盐酸调至pH约为2,缓慢通入Cl2。实验用水浴控制在40℃左右的较低温度下进行的原因是_______。
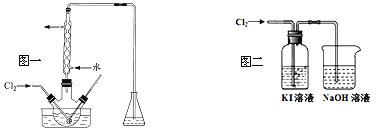
(3)某研究小组用图二装置对Cl2与KI溶液的反应进行探究,发现通入Cl2一段时间后,KI溶液变为黄色,继续通入Cl2,则溶液黄色变浅,最后变为无色。研究小组对所得无色溶液中碘元素的存在形态提出了以下假设:
假设一:没有I2形态;假设二:没有I-形态;假设三:有IO3-形态。
①请设计实验证明假设一成立(试剂自选)。
实验操作 | 预期现象 | 结论 |
___________________ | 假设一成立 |
②若假设三成立,请写出生成IO3-的离子方程式__________________________________。
(4)该研究小组还进行了对加碘盐中KIO3含量测定的如下实验:
①准确称取加碘盐m g于烧杯中,加入适量蒸馏水和过量的KI,再滴入适量的稀硫酸,充分反应,将所得混合液配成250.00mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉试液,用c molL-1Na2S2O3标准液滴定至终点,重复3次,测得平均值为V mL。
已知:IO3-+ 5I-+6H+ =3H2O+3I2,I2 +2S2O32-=2I-+S4O62-。测定时,判断达到滴定终点的现象为___________。由测定数据可求得该样品中含KIO3的质量分数为___________(用含m、c、V的代数式表示,Mr(KIO3)=214 )。
②在滴定操作正确无误的情况下,用此种测定方法测得的结果往往偏高,其原因是受空气的影响,请用离子方程式表示产生这一影响的原因_______________________。
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式(或离子方程式)的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中: Fe + Cu2+ = Cu + Fe2+ | 将Na加入到CuSO4溶液中: 2Na + Cu2+ = Cu + 2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至溶液呈中性: 2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应呈中性: 2H++SO42﹣+Ba++2OH﹣=BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2: Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2: Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO |
A.AB.BC.CD.D
【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
容器编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为![]()
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ