题目内容
【题目】主族元素W、X、Y、Z的原子序数依次增大,W原子最外层电子数是次外层的3倍,X,Y和Z分属于不同的周期,它们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有二组分化合物中,由元素W、Y形成的化合物M的熔点最高。请回答下列问题:
(1)W原子L层电子排布式为__________________W3空间构形是__________________
(2)X单质与水反应的主要化学方程式______________________
(3)化合物M的化学式______________其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是__________________________。将一定是的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂酸醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有____________________,O-C-O的键角约__________
(4) X、Y、Z可形成立方晶体的化合物,其晶胞中X占有棱的中心,Y位于顶角,Z位于体心位置,则该晶体的组成为X:Y:Z=_________________。
(5)含有元素Z的盐的焰色反应为________色,许多金属盐都可以发生焰色反应,其原因是___________________________________________
(6) ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm,密度为_________________________________________g·cm-3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为____________pm。

【答案】2s22p4 V形 2F2+2H2O==4HF+O2 MgO 晶格能大 sp3和sp2 120° 3:1:1 紫 激发态的电子从能量高的轨道跃迁到能量低的轨道时,以一定的波长(可见光区域)光的形式释放能量  gcm-3
gcm-3 ![]() 或
或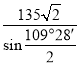 或
或![]()
【解析】
主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍,W原子只能有2个电子层,最外层电子数为6,则W为O元素.X、Y和Z分属不同的周期,它们的原子序数之和是W原子序数的5倍,即三元素原子序数之和为40,X若为第三周期元素,X、Y、Z的原子序数之和大于W原子序数的5倍,所以可以断定X也在第二周期,故X为F元素,则Y、Z原子序数之和=40-9=31,平均原子序数为15.5,可以推断Y处于第三周期、Z处于第四周期,Z的原子序数大于18,若Y为Na元素,则Z为Ca元素,若Y为Mg元素,则Z为K元素,X的原子序数再增大,不符合题目中主族元素的要求,由于元素W与Y形成的化合物M的熔点最高,故Y为Mg元素,Z为K元素,化合物M为MgO
(1)W为O元素,原子的L层电子排布式为 2s22p4,O3分子中中心氧原子价层电子对数=2+![]() =3、含有1对孤电子对,故O3空间构型为V形,故答案为2s22p4;V形;
=3、含有1对孤电子对,故O3空间构型为V形,故答案为2s22p4;V形;
(2)X单质为F2,与水发生反应:2F2+2H2O=4HF+O2,故答案为2F2+2H2O=4HF+O2;
(3)化合物M为MgO,属于离子化合物,由于MgO晶体中离子的电荷多、离子半径小,故MgO晶格能大,故MgO熔点较高;在碳酸二甲酯分子中-OCH3,C原子4个单键,采取sp3杂化,在酯基![]() 中,C原子成2个C-O单键、1个C=O双键,双键按单键计算,故中心C原子的杂化轨道数为3,采取sp2杂化,为平面正三角形,键角为120°,故O-C-O的键角约为120°,故答案为MgO;MgO晶格能比NaCl的大;sp2和sp3;120°;
中,C原子成2个C-O单键、1个C=O双键,双键按单键计算,故中心C原子的杂化轨道数为3,采取sp2杂化,为平面正三角形,键角为120°,故O-C-O的键角约为120°,故答案为MgO;MgO晶格能比NaCl的大;sp2和sp3;120°;
(4)F、Mg、K形成立方晶体结构的化合物,晶胞中F占据所有棱的中心,晶胞中F原子数目为12×![]() =3,Mg位于顶角,晶胞中Mg原子数目为8×
=3,Mg位于顶角,晶胞中Mg原子数目为8×![]() =1,K处于体心位置,晶胞中含有1个K原子,则该晶体的组成为F:Mg:K=3:1:1,故答案为3:1:1;
=1,K处于体心位置,晶胞中含有1个K原子,则该晶体的组成为F:Mg:K=3:1:1,故答案为3:1:1;
(5)含有元素K的盐的焰色反应为紫色,许多金属盐都可以发生焰色反应,其原因为:灼烧时电子从基态到激发态,激发态电子从能量较高的轨道跃迁到能量较低的轨道是,以一定波长光的形式释放能量,从而出现不同的颜色,故答案为紫;灼烧时电子从基态到激发态,激发态电子从能量较高的轨道跃迁到能量较低的轨道是,以一定波长光的形式释放能量;
(6)晶胞中含有白色球位于顶点和面心,共含有8×![]() +6×
+6×![]() =4,黑色球位于体心,共4个,则晶胞中平均含有4个ZnS,质量为4×(87÷6.02×1023)g,晶胞的体积为(540.0×10-10cm)3,则密度为
=4,黑色球位于体心,共4个,则晶胞中平均含有4个ZnS,质量为4×(87÷6.02×1023)g,晶胞的体积为(540.0×10-10cm)3,则密度为 gcm-3;
gcm-3;
b位置黑色球与周围4个白色球构成正四面体结构,黑色球与两个白色球连线夹角为109°28′,a位置白色球与面心白色球距离为540.0pm×![]() =270
=270![]() pm,设a位置S2-与b位置Zn2+之间的距离为y pm,由三角形中相邻两边、夹角与第三边关系:y2+y2-2y2cos109°28′=(270
pm,设a位置S2-与b位置Zn2+之间的距离为y pm,由三角形中相邻两边、夹角与第三边关系:y2+y2-2y2cos109°28′=(270![]() )2,解得y=
)2,解得y=![]() ,故答案为
,故答案为 gcm-3;
gcm-3;![]() 。
。
【点晴】
本题是对物质结构与性质的考查,涉及核外电子排布、分子结构与性质、晶体类型与性质、晶胞计算等。推断元素是解题的关键,要充分利用原子序数的关系结合周期表的结构进行判断元素。本题中晶胞计算需要学生具备一定的空间想象与数学计算能力,难度较大。第(6)小题的思维过程如下:在此晶胞中有Zn2+为4个、S2-为8×![]() +6×
+6×![]() =4个,所以1 mol晶胞的质量为(65+32)×4=388 g,一个晶胞的质量为
=4个,所以1 mol晶胞的质量为(65+32)×4=388 g,一个晶胞的质量为![]() ,一个晶胞的体积为V=(540×10-10cm)3,根据
,一个晶胞的体积为V=(540×10-10cm)3,根据![]() 即可计算;b点(Zn2+)在由A、H、C、D四点构成的正四面体的中心,所以∠ABH=109°28′。
即可计算;b点(Zn2+)在由A、H、C、D四点构成的正四面体的中心,所以∠ABH=109°28′。
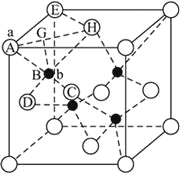
如图所示,连结AH、EH,求得![]() ,作BG垂直于AH,
,作BG垂直于AH,![]() ,
,![]() ,通过三角函数即可求出。
,通过三角函数即可求出。

 精英口算卡系列答案
精英口算卡系列答案【题目】相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g) + 3Y2(g) ![]() 2XY3(g) △H=-92.6kJ/mol
2XY3(g) △H=-92.6kJ/mol
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 23.15 kJ |
② | 0.6 | 1.8 | 0.8 | Q kJ |
下列叙述正确的是
A. 容器①、②中反应的平衡常数不相等
B. 达平衡时,两个容器中XY3的物质的量浓度均为2 mol/L
C. 容器②中反应达到平衡时放出的热量为23.15kJ
D. 若容器①体积为0.20 L,则达平衡时放出的热量小于23.15 kJ