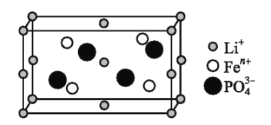
题目内容
【题目】为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。
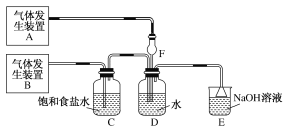
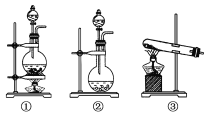
(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是________;发生装置B应选择以下三种装置中的________(选填序号)。
(2)D装置中主要反应的离子方程式为_______________________
(3)为验证通入D装置中的气体是Cl2过量还是SO2过量,兴趣小组的同学准备了以下试剂:
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液 ⑤酸性高锰酸钾溶液
若Cl2过量,取适量D中溶液滴加至盛有________(选填一个序号)试剂的试管内,再加入________(选填一个序号)试剂。发生的现象是______________。若SO2过量,取适量D中溶液滴加至盛有________(选填一个序号)试剂的试管内,发生的现象是_________。
【答案】防倒吸 ① Cl2+SO2+2H2O===4H++SO42-+2Cl- ② ③ 溶液呈红色 ④(或⑤) 红色(或紫红色)褪为无色
【解析】
依据实验目的可知A、B气体中,一种是二氧化硫,一种是氯气,制备氯气中含有杂质氯化氢,需要通过饱和食盐水除去氯化氢,故装置B氯气,装置A生成二氧化硫,二者在D中进行反应,装置E可以除去未反应的气体。
(1) A装置为制取SO2的装置,因SO2易溶于水,故F仪器的作用为防倒吸;制取Cl2所用试剂为MnO2和浓盐酸,属于固、液混合加热制取气体,故应选①装置为发生装置B;
(2)装Cl2和SO2同时通入水中时,Cl2将SO2氧化生成H2SO4,Cl2被还原为HCl,方程式为Cl2+SO2+2H2O===4H++SO42-+2Cl-。
(3)若Cl2过量,则在D中溶液中除含H2SO4、HCl外,还含有剩余Cl2及HClO,具有强氧化性,可将Fe2+氧化为Fe3+,滴加硫氰化钾溶液会变红,故可选择②③进行检验;若SO2过量,则在D中溶液中会含有SO2、H2SO3,SO2具有漂白性能使品红溶液褪色,同时也有还原性可使酸性高锰酸钾溶液褪色,故可选用④或⑤进行检验。

【题目】相同温度下体积均为2L的两个恒容容器中发生可逆反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196kJ·mol-1,实验测得有关数据如下表:
2SO3(g) △H=-196kJ·mol-1,实验测得有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
SO2 | O2 | SO3 | ||
① | 2 | 1 | 0 | 放热 156.8 kJ |
② | 0.6 | 0.3 | 1.4 | Q(Q>0) |
下列叙述不正确的是
A. 容器①中达到平衡吋,O2的转化率为80%
B. Q=19.6kJ
C. 容器①、②中反应的平衡常数相等,K=80
D. 相同温度下,起始时向容器中充入0.8 mol SO2、0.4 mol O2和3.2 mol SO3,反应达到平衡前v(正)>v(逆)