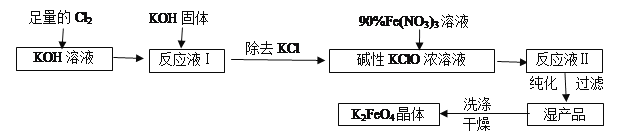
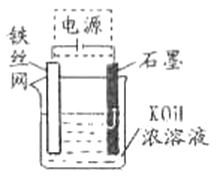
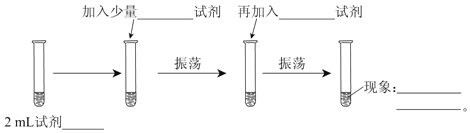
题目内容
【题目】关于反应速率、反应限度的下列说法中正确的是( )
A.其他条件不变时,升高温度,只有吸热反应,反应速率加快
B.化学反应的限度是不可改变的
C.化学反应达到反应限度时,反应物的浓度与生成物的浓度相等
D.化学反应达到反应限度时,同一物质的正反应速率与逆反应速率相等
【答案】D
【解析】
A.升高温度,单位体积内活化分子百分数增大,反应速率加快,与反应的吸热放热无关,A错误;
B.化学反应的限度是可以改变的,改变影响化学平衡因素的条件之一,化学反应限度相应改变,B错误;
C.化学反应达到限度时,反应物浓度与生成物浓度不一定相同,C错误;
D.化学反应达到反应限度时,同一物质的正反应速率与逆反应速率相等,D正确;
故选D。

【题目】(1)用0.lmol·L-1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
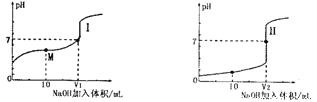
①滴定醋酸的曲线是__________(填“I”或“Ⅱ”)。
②V1和V2的关系:V1______V2(填“>”、“=”或“<”)
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______________。
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。资料:AgSCN是白色沉淀
操作步骤 | 现象 |
步骤1:向2mL0.005mol·L-1AgNO3溶液中 加入2mL0.005mol·L-1KSCN溶液,静置 | 出现白色沉淀 |
步骤2:取lmL上层清液于试管中,滴加1 滴2 mol·L-1Fe(NO3)3溶液 | 溶液变红色 |
步骤3:向步骤2的溶液中,继续加入5滴3mol·L-1 AgNO3溶液 | 出现白色沉淀,溶液红色变浅 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液 | 出现黄色沉淀 |
①写出步骤2中溶液变红色的离子方程式______________________。
②用化学平衡原理解释步骤3的实验现象______________________。
【题目】根据所给的信息和标志,判断下列说法正确的是
A | B | C | D |
《本草纲目拾遗》中述“铁线粉”:“粤中洋行有舶上铁丝,……日久起销,用刀刮其销,.....,所刮下之销末,名铁线粉” | 《本草纲目》:“(火药)乃焰消(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者” | 可燃冰 |
|
“铁线粉”是Fe3O4 | 利用KNO3的氧化性 | “可燃冰”是可以燃烧的水 | “绿色食品”是指绿色的食品 |
A. A B. B C. C D. D