题目内容
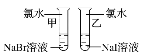
【题目】甲同学拟通过实验探究同主族元素性质的递变规律。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂:NaBr溶液、NaI溶液、新制的氯水
(1)写出下列实验报告中的实验现象和离子方程式
实验步骤 | 实验现象 | 实验结论及离子方程式 |
| 甲_______ 乙_______ | 离子方程式 甲__________ 乙__________ 结论:卤素单质的氧化性由强到弱的顺序为Cl2>Br2>I2 |
(2)[评价]甲同学设计的实验方案的合理性是_____(填字母)。
A.非常合理 B.部分合理 C.完全不合理
【答案】溶液由无色变为橙色 溶液由无色变为黄色 2Br-+Cl2===Br2+2Cl- 2I-+Cl2===I2+2Cl- B
【解析】
根据氯气氧化性大于溴单质和碘单质的氧化性分析并写出反应的离子方程式;由于乙试管使用的是氯水,无法证明溴单质的氧化性大于碘单质的氧化性。
(1)甲试管中加入氯水,溶液中溴离子被氯气氧化成溴单质,溶液由无色变为橙色,反应的离子方程式为:2Br-+Cl2=Br2+2Cl-,
乙试管中加入氯水,溶液中的碘离子被氯气氧化成碘单质,溶液由无色变为黄色,反应的离子方程式为:2I-+Cl2=I2+2Cl-,
由于乙试管使用的是氯水,无法证明溴单质的氧化性大于碘单质的氧化性,甲同学设计的实验方案部分合理,所以试管乙应该使用溴水,
故答案为:
实验步骤 | 实验现象 | 实验结论及离子方程式 |
| 甲:溶液由无色变为橙色 乙:溶液由无色变为黄色 | 离子方程式 甲:2Br-+Cl2=Br2+2Cl- 乙:2I-+Cl2=I2+2Cl- 结论:卤素单质的氧化性由强到弱的顺序为Cl2>Br2>I2 |
(2)[评价]甲同学设计的实验方案合理。

【题目】某实验小组收集“铜与浓硝酸反应”生成的气体进行探究。试回答下列问题
(1)下图是“铜与浓硝酸反应”的实验装置
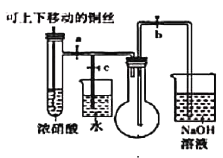
①指出装置中的错误_________________________。
②装置改进后,为了使生成的气体充满烧瓶,实验时先关闭弹簧夹_______,再打开弹簧夹________。
③当气体充满烧瓶后,___________________________,即可使反应停止。
(2)当烧瓶中充满红棕色的气体时停止实验,取下烧瓶,塞好橡皮塞。
①把烧瓶倒扣在装水的水槽中并打开烧瓶的橡皮塞,烧瓶中水面上升,根据化学方程式3NO2+H2O=2HNO3+NO计算烧瓶中溶液的浓度是______mol/L(假设溶质未扩散到水槽,且当时条件下气体的摩尔体积为25L/mol)
②把烧瓶倒扣在装水的水槽中并打开烧瓶的橡皮塞,实验时发现烧瓶中液面上升几乎充满了整个烧瓶,产生这种现象的原因可能是收集的NO2中含有__________。
A.NO B.N2O4 C.O2 D.空气
③小组同学查阅资料发现,NO2溶于水时能生成硝酸和亚硝酸:2NO2+H2O=HNO3+HNO2,为了证明这是造成剩余气体少的主要原因,小组同学把烧瓶中的溶液滴加高锰酸钾溶液,发现高锰酸钾溶液褪色,写出高锰酸钾溶液褪色的离子方程式____________________________。
(3)HNO2是一种不稳定易分解的弱酸:Ⅰ.2HNO2=NO↑+NO2↑+H2O,Ⅱ.3HNO2=HNO3+2NO↑+H2O。为了探究不同温度、浓度下亚硝酸的分解产物,小组同学进行如下实验:
第一步:配制1mol/LNaNO2溶液100mL(标为溶液A)。
第二步:取溶液A分别加水稀释为0.5mol/L、0.2mol/L、0.1mol/L的溶液,依次标为溶液B、C、D。
第三步:分别取两滴管溶液A~D溶液于试管中,塞上橡皮塞后置于不同温度的水中加热5min,再加入一滴管10mol/LH2SO4溶液并立即塞紧橡皮塞,观察生成气体的颜色
水浴温度/℃ | A | B | C | D |
沸水浴 | 红棕色 | 红棕色 | 红棕色 | 红棕色 |
80-70 | 红棕色 | 红棕色 | 红棕色 | 无色 |
50-40 | 红棕色 | 仅液面上红棕色 | 无色 | 无色 |
20-10 | 仅液面上红棕色 | 无色 | 无色 | td style="width:88.95pt; border-top-style:solid; border-top-width:0.75pt; border-left-style:solid; border-left-width:0.75pt; padding:3.38pt 5.03pt; vertical-align:middle">
①第一步实验要用到玻璃仪器有:烧杯、100mL容量瓶、玻璃棒和___________。
②用NaNO2溶液加硫酸而不直接用HNO2溶液的原因是______________。
③通过实验现象得出结论:____________条件下,亚硝酸按反应Ⅰ发生分解。