题目内容
【题目】(1)铝—空气燃料电池是一种新型的燃料电池,其工作原理如图所示,其中电解质溶液是KOH溶液,正极反应式为O2+2H2O+4e-===4OH-。试完成下列问题:
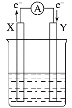
①通入空气的电极是___(填“正”或“负”)极。
②Al电极是___(填“X”或“Y”)电极。
③电池总反应式为______(写离子方程式)。
(2)航天技术中使用的氢氧燃料电池具有高能.轻便和无污染等优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式都为2H2+O2===2H2O。
①酸式氢氧燃料电池的电解质溶液是稀硫酸,其负极反应式为2H2-4e-===4H+,则其正极反应式为______;
②碱式氢氧燃料电池的电解质溶液是KOH溶液,则其负极反应式为_____。
【答案】正 X 4Al+4OH-+3O2===4AlO2-+2H2O O2+4H++4e-===2H2O 2H2+4OH--4e-===4H2O
【解析】
(1)电池中Al与O 2发生反应:4Al+3O2=2Al2O3 ,Al失去电子作负极,O2在正极得到电子,则通入空气的电极为正极;电子由X极流向Y极,则X极为负极,即X极为Al电极。生成的Al2O3能与NaOH溶液反应生成NaAlO2,故电池总反应的离子方程式为4Al+4OH-+3O2=4AlO2-+2H2O;
(2)两电极反应相加即得电池总反应,因此,用电池总反应减去某电极的电极反应,即得另一电极的电极反应。酸式氢氧燃料电池,负极反应为2H2-4e-=4H+,电池总反应为2H2+O2=2H2O,则正极反应为O2+4H++4e-=2H2O;碱式氢氧燃料电池,正极反应为O2+2H2O+4e- = 4OH-,电池总反应为2H2+O2=2H2O,则负极反应为2H2+4OH--4e-===4H2O。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
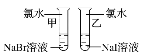
直通贵州名校周测月考直通名校系列答案【题目】甲同学拟通过实验探究同主族元素性质的递变规律。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂:NaBr溶液、NaI溶液、新制的氯水
(1)写出下列实验报告中的实验现象和离子方程式
实验步骤 | 实验现象 | 实验结论及离子方程式 |
| 甲_______ 乙_______ | 离子方程式 甲__________ 乙__________ 结论:卤素单质的氧化性由强到弱的顺序为Cl2>Br2>I2 |
(2)[评价]甲同学设计的实验方案的合理性是_____(填字母)。
A.非常合理 B.部分合理 C.完全不合理