题目内容
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)催化转化器可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5 kJ/mol;
2C(s)+O2(g)=2CO(g) △H2=-221.0 kJ/mol;
C(s)+O2(g)=CO2(g) △H3=-393.5 kJ/mol
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=___________。
(2)氨是一种重要的化工原料,在工农业生产中有广泛的应用。在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间(t)的关系如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
①该温度下,若向同容积的另一容器中投入N2、H2、NH3,其浓度均为3 mol/L,则此时v正____v逆(填“大于”“小于”或“等于”)。
②由表中的实验数据可得到“c—t”的关系,如图所示,表示c(N2)—t的曲线是______。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)—t的曲线上相应的点为________。

(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) △H=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
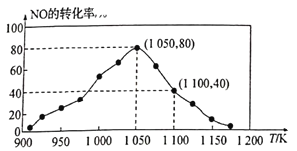
①由图可知,在1100K时,CO2的体积分数为__________。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=______[已知:气体分压(P分)=气体总压(Pa)×体积分数]。
(4)在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯![]() 原理如图所示
原理如图所示
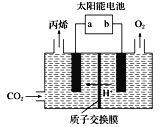
①太阳能电池的负极是_______(填“a”或“b”)
②生成丙烯的电极反应式是___________。
【答案】-746.5 kJ /mol 大于 乙 B 20% 4 a 3CO2+18H++18e-=C3H6+6H2O
【解析】
(1)根据盖斯定律将已知的热化学方程式,根据③×2-②-①叠加可得相应热化学方程式;
(2)①由表中数据可知,25min达到平衡,根据物质反应转化关系,计算出各种物质的瓶内浓度,得到该温度下的化学平衡常数,将物质的此时浓度带入浓度商计算并与K比较判断;
②c(N2)从2mol/L减小为1mol/L,在此温度下,若起始充入4 mol N2和12 molH2,压强为原来的2倍,增大压强平衡正向移动,则3mol/L<c(H2)<6mol/L;
(3)①由图可知,1050K前反应中NO的转化率随温度升高而增大,反应速率加快;图中1100K时,NO的转化率为40%,假设反应开始时NO的物质的量为a,根据NO的转化率及物质反应转化关系,计算出平衡时各种气体的物质的量,利用阿伏加德罗定律及其推论计算体积分数;
②根据1050K、1.1×106Pa时,NO的转化率为80%,计算出平衡时各种气体的物质的量,结合气体分压(P分)=气体总压(Pa)×体积分数,以此计算Kp;
(4)由图可知,阴极上CO2得到电子生成丙烯,则a为负极,以此来解答。
(1)由于反应热与反应途径无关,只与物质的始态和终态有关,所以根据盖斯定律③×2-②-①进行叠加,可得相应热化学方程式:NO(g) +2CO(g)=N2(g)+2CO2(g) △H=-746.5 kJ /mol;
(2)由表中数据可知,25min达到平衡,平衡时各种物质的浓度c(NH3)=2.0mol/L,c(H2)=3.0mol/L,c(N2)=1.0mol/L,则该温度下的化学平衡常数K=![]() =
=![]() 。
。
①该温度下,若向同容积的另一容器中投入N2、H2、NH3,其浓度均为3.0 mol/L,则Qc=![]() =
=![]() <K,说明反应正向进行,v正>v逆;
<K,说明反应正向进行,v正>v逆;
②c(N2)从2mol/L减小为1mol/L,则表示c(N2)-t的曲线是乙,在此温度下,若起始充入4 mol N2和12 mol H2,压强为原来的2倍,增大压强,化学平衡向气体体积减小的正反应方向移动,则3mol/L<c(H2)<6mol/L,且浓度增大,反应速率加快,则达到平衡时,表示c(H2)-t的曲线上相应的点为B;
(3)①由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为1050K前反应未达到平衡状态,随着温度升高,反应速率加快,NO转化率增大;图中1100K时,NO的转化率为40%,则根据反应方程式C(s)+2NO(g)![]() N2(g)+CO2(g),假设反应开始时NO的物质的量为a,平衡时NO为0.6a,N2为0.2a,CO2为0.2a,由于在同温同压下,气体的体积比等于气体的物质的量的比,则CO2占的体积分数=
N2(g)+CO2(g),假设反应开始时NO的物质的量为a,平衡时NO为0.6a,N2为0.2a,CO2为0.2a,由于在同温同压下,气体的体积比等于气体的物质的量的比,则CO2占的体积分数=![]() ×100%=20%;
×100%=20%;
②1050K、1.1×106Pa时,NO的转化率为80%,则根据反应方程式C(s)+2NO(g)![]() N2(g)+CO2(g),假设反应开始时NO的物质的量为a,平衡时NO为0.2a,N2为0.4a,CO2为0.4a,气体的总物质的量为0.2a+0.4a+0.4a=a。气体分压=气体总压×气体的体积分数,则化学平衡常数Kp=
N2(g)+CO2(g),假设反应开始时NO的物质的量为a,平衡时NO为0.2a,N2为0.4a,CO2为0.4a,气体的总物质的量为0.2a+0.4a+0.4a=a。气体分压=气体总压×气体的体积分数,则化学平衡常数Kp=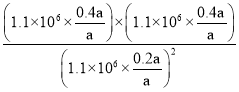 =4;
=4;
(4)①由图可知,阴极上CO2中的C得到电子,发生还原反应,所以太阳能电池的负极是a;
②在a电极上生成丙烯的电极反应式是3CO2+18H++18e-=C3H6+6H2O。

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】T ℃时,在容积为2 L的3个恒容密闭容器中发生反应:3A(g)+B(g)![]() nC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
nC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物的投入量 | 3 mol A、2 mol B | 6 mol A、4 mol B | 2 mol C |
达到平衡的时间/min | 5 | 8 | |
A的浓度/mol·L-1 | c1 | c2 | |
C的体积分数% | w1 | w3 | |
混合气体的密度/g·L-1 | ρ1 | ρ2 |
下列说法正确的是( )
A. 若n<4,则2c1<c2
B. 若n=4,则w3=w1
C. 无论n的值是多少均有2ρ1=ρ2
D. 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短
【题目】氯化亚铜是一种重要的化工原料,一种利用低品位铜矿![]() 主要含有Cu2S、CuS、FeO、Fe2O3、SiO2等
主要含有Cu2S、CuS、FeO、Fe2O3、SiO2等![]() 为原料制取CuCl的工艺流程如下:
为原料制取CuCl的工艺流程如下:
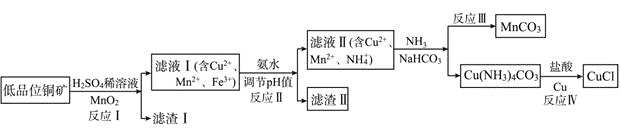
(1)反应Ⅰ“浸取”前需将铜矿粉碎的目的是___________________________;
(2)滤渣Ⅰ的成分除S和![]() 外还含有___________,反应 Ⅰ中
外还含有___________,反应 Ⅰ中![]() 的作用为_______________
的作用为_______________
(3)已知生成氢氧化物的pH如下表,则反应Ⅱ“中和”时,用氨水调pH的范围是______________。
物质 |
|
|
|
开始沉淀pH |
|
|
|
完全沉淀pH |
|
|
|
(4)检验滤液Ⅱ中是否含有![]() 所需要的试剂是:______________
所需要的试剂是:______________
(5)①反应Ⅲ中生成难溶![]() 的离子方程式:______________
的离子方程式:______________
②反应Ⅳ所对应的化学方程式:______________________________
(6) CuCl的定量分析
步骤1.取样品0.7500g和30.0mL 1.0mol·L-1过量的FeCl3溶液置于250mL的锥形瓶中,不断摇动。
步骤2.待样品溶解后,平均分为3份,用0.1000mol·L-1 Ce(SO4)2标准溶液进行滴定。
三次实验测得数据如下表
序号 | 1 | 2 | 3 |
起始读数 |
|
|
|
终点读数 |
|
|
|
已知:![]() ;
;![]() 。
。
①数据处理:计算得CuCl的纯度为_________![]()
②误差下列操作会使测定结果偏高的是______________
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线
C.0.1000mol·L-1硫酸铈溶液久置后浓度变小
D.滴定前滴定管尖嘴无气泡,滴定后产生气泡
E.用量筒取10.0mL 1.0mol·L-1的![]() 溶液时仰视刻度线
溶液时仰视刻度线