题目内容
【题目】硫酸铜溶液中滴入乙二胺(H2N—CH2—CH2—NH2)即可形成配离子A,其结构如图:

(1)基态的Cu2+核外电子排布式为________。
(2)元素C、N、O的第一电离能由大到小排列顺序为_______;![]() 的空间构型为________。
的空间构型为________。
(3)A中所形成的配离子中含有的化学键类型有__________(填标号)。
a.配位键 b.极性键 c.离子键 d.非极性键
(4)乙二胺分子中氮原子轨道的杂化类型为___________,乙二胺和三甲胺 [N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是________。
(5)硫酸铜灼烧可以生成一种红色晶体,其结构如图所示,则该化合物的化学式是____。已知晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,求晶胞边长a=______cm。(用含ρ、NA的计算式表示)

【答案】ls22s22p63s23p6 3d9或[Ar] 3d9 N>O> C 正四面体 abd sp3 乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键 Cu2O ![]()
【解析】
(1)铜是29号元素失去外层两个电子形成铜离子;
(2)根据同周期从左到右,元素的第一电离能呈增大趋势,但N元素原子的2p能级处于半满稳定状态,能量较低,第一电离能高于同周期相邻的元素;根据价层电子对互斥理论判断空间构型;
(3)根据成键原子的特点判断化学键类型;
(4)根据价层电子对数判断乙二胺分子中氮原子的杂化类型,根据是否含有氢键分析二者熔沸点高低不同的原因;
(5)均摊法计算晶胞中Cu、O原子数目,确定化学式;结合晶胞中原子数目计算晶胞质量,再根据晶胞体积求晶体密度=晶胞质量÷晶胞体积。
(1)Cu是29号元素,处于第四周期IB族,核外电子排布式为:1s22s22p63s23p63d104s1,失去最外层两个电子形成Cu2+,所以基态的Cu2+核外电子排布式为ls22s22p63s23p6 3d9或[Ar] 3d9;
(2)根据分析可知元素C、N、O的第一电离能由大到小排列顺序为N>O> C;SO42-中S原子孤电子对数=![]() ,价层电子对数为
,价层电子对数为![]() ,所以为sp3杂化,分子空间构型为正四面体,故答案为:N>O> C;正四面体;
,所以为sp3杂化,分子空间构型为正四面体,故答案为:N>O> C;正四面体;
(3)A中所形成的配离子中含有的化学键中N与Cu之间为配位键,C-C键为非极性键,C-N、N-H、C-H键为极性键,不含离子键,故答案为:abd;
(4)乙二胺分子中氮原子形成3个σ键,还有一孤电子对,所以价层电子对数为4,所以氮原子为sp3杂化,乙二胺分子间可以形成氢键,物质的熔沸点较高,而三甲胺分子间不能形成氢键,熔沸点较低,故答案为:sp3;乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;
(5)Cu原子位于晶胞内部,O原子处于晶胞体心、顶点,晶胞中Cu原子数目=4、O原子数目=1+8×![]() =2,Cu、O原子数目之比为2:1,故化学式为Cu2O;晶胞质量m=
=2,Cu、O原子数目之比为2:1,故化学式为Cu2O;晶胞质量m=![]() ,若晶胞边长为acm,则晶胞体积为V =a3cm3,则晶胞密度
,若晶胞边长为acm,则晶胞体积为V =a3cm3,则晶胞密度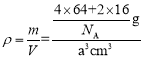 ,解得a=
,解得a=![]() cm,故答案为:Cu2O;
cm,故答案为:Cu2O;![]() 。
。