题目内容
【题目】氮及其化合物在工农业生产、生活中有着重要应用。
(1)烟气中的氮氧化物(NOx)可与甲烷在一定条件下反应转化为无害成分,从而消除污染。已知
反应 | 反应热(△H/kJ·mol-1) | 平衡常数(K) |
CH4(g)+2O2(g)═CO2(g)+2H2O(l) | a | K1 |
N2(g)+O2(g)═2NO(g) | b | K2 |
则CH4脱硝的热化学方程式为CH4(g) + 4NO (g)CO2(g) + 2N2(g) + 2H2O ΔH=_________kJ/mol(用a、b表示);平衡常数K3=_________(用K1、K2表示)。
(2)用活性炭还原法可以消除NO 的污染,发生的反应为C(s)+2NO(g)N2(g)+CO2(g)。1molNO 和足量的活性炭在T℃、容积恒定为2L的密闭容器中反应,经过5min反应达到平衡,测得NO的物质的量为0.4mol。
①从反应开始到5min,用氮气表示的平均反应速率为_________。达到平衡后,向容器中再通入0.1molNO气体和0.3molCO2气体,则此平衡将_________(填“正向移动”“不移动”或“逆向移动”)。
②能判断该反应一定达到化学平衡状态的依据是_________(填标号)。
a.NO和N2的体积比保持不变
b.单位时间内生成2nmolNO的同时消耗nmolCO2
c.恒温恒容条件下,反应体系的压强不再发生改变
d.恒容条件下,混合气体的平均相对分子质量不变
(3)某实验小组模拟4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200kJ·mol-1净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%,则该反应的平衡常数为__________;两种方式达平衡时,N2的体积分数:甲______乙(填“>、=、<或不确定”)
甲 | 乙 |
0.2molNO2 | 0.1molNO2 |
0.4molCO | 0.2molCO |
【答案】a﹣2b ![]() 0.03mol/(L.min) 逆向移动 d 10 >
0.03mol/(L.min) 逆向移动 d 10 >
【解析】
(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式,平衡常数=![]() ,依据反应的平衡常数计算分析平衡常数的关系;
,依据反应的平衡常数计算分析平衡常数的关系;
(2)①根据NO的物质的量变化计算NO的消耗速率,再由计量数之比等于化学反应速率之比计算N2的生成速率,根据Qc与K的关系判断化学反应的方向;
②反应达到平衡时,v正=v逆,混合气体的平均相对分子质量为m,据此逐项分析;
(3)结合反应,列“三段式”求解平衡常数,温度不变,平衡常数不变,计算乙中氮气的体积分数。
(1) ①CH4(g)+2O2(g)═CO2(g)+2H2O(l)K1=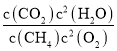 △H=akJmol1;②N2(g)+O2(g)═2NO(g)K2=
△H=akJmol1;②N2(g)+O2(g)═2NO(g)K2=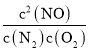 △H=bkJmol1;依据盖斯定律计算,①②×2得到CH4脱硝的热化学方程式为CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l)△H=(a2b)kJmol1;K3=
△H=bkJmol1;依据盖斯定律计算,①②×2得到CH4脱硝的热化学方程式为CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l)△H=(a2b)kJmol1;K3=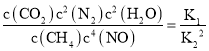 ;
;
(2) ①1molNO 和足量的活性炭在TC、容积恒定为2L的密闭容器中反应,经过5min反应达到平衡,测得NO的物质的量为0.4mol,则NO的消耗速率为v(NO)=![]() =0.06mol/(Lmin),再由计量数之比等于化学反应速率之比,则N2的生成速率为
=0.06mol/(Lmin),再由计量数之比等于化学反应速率之比,则N2的生成速率为![]() v(NO)=0.03mol/(Lmin),
v(NO)=0.03mol/(Lmin),

所以化学平衡常数K=![]() =
=![]() =916;
=916;
达到平衡后,向容器中再通入0.1molNO气体和0.3molCO2气体,则Qc=![]() =1825>K,所以平衡逆向移动;
=1825>K,所以平衡逆向移动;
②a.NO和N2的体积比取决于反应物的通入量,反应进行的程度,不能通过NO和N2的体积比保持不变判断化学反应达到平衡,故a不符合题意;
b.单位时间内生成2molNO的同时消耗1molCO2,说明化学反应达到平衡,不是nmolCO2,故b不符合题意;
c.恒温恒容条件下,反应体系的压强不再发生改变,反应为气体分子数不变的反应,整个反应过程,体系压强始终不变,不能通过压强说明反应达到平衡,故c不符合题意;
d.混合气体的平均相对分子质量为![]() ,反应前后混合气体总物质的量n不变,混合气体总质量m改变,则混合气体的平均相对分子质量改变,当混合气体的平均相对分子质量,一定可以说明化学反应达到平衡,故d符合题意;
,反应前后混合气体总物质的量n不变,混合气体总质量m改变,则混合气体的平均相对分子质量改变,当混合气体的平均相对分子质量,一定可以说明化学反应达到平衡,故d符合题意;
故答案为:d;
(3) 已知:4CO(g)+2NO2(g) 4CO2(g)+N2(g) 一定温度下,在2L的恒容密闭容器中,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%,列“三段式”:

则甲中反应的平衡常数为K=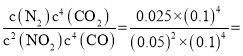 10;条件不变的情况下,甲的投料比是乙的两倍,即可认为甲是乙达到平衡后增大压强促使平衡正向移动,N2的体积分数分数增大。
10;条件不变的情况下,甲的投料比是乙的两倍,即可认为甲是乙达到平衡后增大压强促使平衡正向移动,N2的体积分数分数增大。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
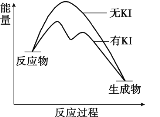
暑假衔接培优教材浙江工商大学出版社系列答案【题目】向20 mL 0.40 mol/L H2O2溶液中加入少量KI溶液:ⅰ.H2O2+I-=H2O+IO﹣;ⅱ.H2O2+IO﹣= H2O+O2↑+ I﹣。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下。
t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
下列判断不正确的是
A. 从图中可以看出,KI能增大H2O2的分解速率
B. 反应ⅰ是放热反应,反应ⅱ是吸热反应
C. 0~10 min的平均反应速率:v(H2O2)≈9.0×10-3 mol/(L·min)
D. H2O2在反应过程中既体现了氧化性,又体现了还原性