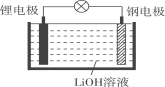
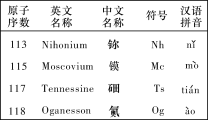
题目内容
【题目】已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
CO(g)+1/2O2(g)=CO2(g)△H=-282.9kJ/mol
某H2与CO的混合气体完全燃烧放出113.74kJ热量,同时生成3.6g液态水,则原混合气体中H2与CO的物质的量之比是( )
A. 1:1 B. 1:3 C. 1:4 D. 2:3
【答案】A
【解析】
根据反应2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ/mol、CO(g)+![]() O2(g)=CO2(g) △H=-282.9kJ/mol可知氢气的燃烧为285.8kJ/mol,CO的燃烧热为282.9kJ/mol,3.6g液态水的物质的量为:
O2(g)=CO2(g) △H=-282.9kJ/mol可知氢气的燃烧为285.8kJ/mol,CO的燃烧热为282.9kJ/mol,3.6g液态水的物质的量为:![]() =0.2mol,根据H元素守恒可知原混合气体中含有氢气的物质的量为:n(H2)=n(H2O)=0.2mol,0.2mol氢气完全燃烧放出的热量为:285.8kJ/mol×0.2mol=57.16kJ,则混合气体中CO完全燃烧放出的热量为:113.74kJ-57.16kJ=56.58kJ,则CO的物质的量为:n(CO)=
=0.2mol,根据H元素守恒可知原混合气体中含有氢气的物质的量为:n(H2)=n(H2O)=0.2mol,0.2mol氢气完全燃烧放出的热量为:285.8kJ/mol×0.2mol=57.16kJ,则混合气体中CO完全燃烧放出的热量为:113.74kJ-57.16kJ=56.58kJ,则CO的物质的量为:n(CO)=![]() =0.2mol,相同条件下气体的体积之比等于物质的量之比,则原混合气体中H2与CO的物质的量之比=0.2mol:0.2mol=1:1,故选A。
=0.2mol,相同条件下气体的体积之比等于物质的量之比,则原混合气体中H2与CO的物质的量之比=0.2mol:0.2mol=1:1,故选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。
【题目】X、Y、Z、W代表四种短周期元素,有关它们的部分结构信息及性质信息如表所示。
元素 | 部分结构信息 | 部分性质信息 |
X | X的单质由双原子分子构成 | X的氢化物水溶液呈碱性 |
Y | Y原子的最外层电子数是其内层电子数的两倍 | Y能形成多种气态氢化物 |
Z | Z原子有三个电子层 | 含有Z元素的化合物的焰色反应呈黄色 |
W | W原子的最外层电子数等于(2n+1)(n为原子核外电子层数) | W和Z能按1∶1的原子个数比形成离子化合物 |
请按要求回答下列问题:
(1)W在元素周期表中的位置是______。
(2)X简单气态氢化物的分子式为______。(用化学式表示)
(3)X、Y、W三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是______。(用化学式表示)
(4)Z单质在W单质中发生反应的实验现象是______。
(5)写出W的单质与二氧化硫的混合气体通入水中所发生反应的离子方程式:______。