题目内容
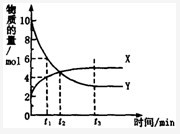
在盛有足量M的体积可变的密容器中加入N,发生反应:M(s)+2N(g) 4P (g)+Q(g)
4P (g)+Q(g)
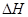 <0。在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的变化关系如图所示。下列说法正确的是:
<0。在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的变化关系如图所示。下列说法正确的是: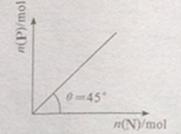
| A.平衡时N的转化率为50% |
B.当温度升高后,则图中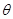 >45 >45 |
| C.若再加入N,则正、逆反应速率均逐渐增大 |
| D.若再加入N,则反应体系中气体密度减小 |
A
解析试题分析:A、根据图像结合方程式知,加入的N的物质的量与生成P的物质的量相等,所以该反应中有一半的N反应,所以N的转化率为50%,正确;B、压强一定,当升高温度时,平衡逆向移动,则P的物质的量会减少,由图可以看出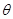 <45
<45 ,错误;C、因体积可变,再加入N时N的浓度不变,正、逆反应速率不变,错误;D、根据图像结合方程式知,加入的N的物质的量与生成P的物质的量相等,所以该反应中就有一半的N参加反应,根据方程式计算可得:只要温度不变,气体的平均摩尔质量就不变,所以若再加入N,再次达到平衡时体系气体密度始终不变,错误。
,错误;C、因体积可变,再加入N时N的浓度不变,正、逆反应速率不变,错误;D、根据图像结合方程式知,加入的N的物质的量与生成P的物质的量相等,所以该反应中就有一半的N参加反应,根据方程式计算可得:只要温度不变,气体的平均摩尔质量就不变,所以若再加入N,再次达到平衡时体系气体密度始终不变,错误。
考点:化学平衡的影响因素。

练习册系列答案
相关题目
下列措施对增大反应速率明显有效的是( )
| A.Na与水反应时增大水的用量 |
| B.Fe与稀硫酸反应制取氢气时,改用浓硫酸 |
| C.在H2SO4与Na2CO3两溶液反应时,增大压强 |
D.反应N2+3H2 2NH3恒容增加氮气 2NH3恒容增加氮气 |
在一不可变容器中发生如下反应:2NO2 2NO + O2 ΔH >0 达到平衡后,升温,混合气体的( )不变
2NO + O2 ΔH >0 达到平衡后,升温,混合气体的( )不变
| A.密度 | B.颜色 | C.压强 | D.总物质的量 |
已知298 K时,合成氨反应N2(g)+3H2(g)  2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
| A.一定小于92.0 kJ | B.一定大于92.0 kJ |
| C.一定等于92.0 kJ | D.无法确定 |
运用相关化学知识进行判断,下列结论错误的是
| A.某吸热反应能自发进行,因此该反应是熵增反应 |
| B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 |
| C.可燃冰主要甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 |
| D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
 设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是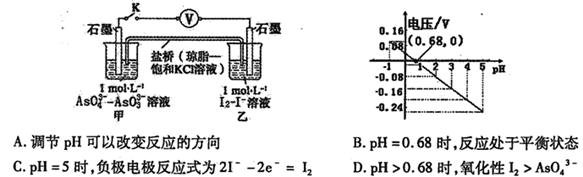
 2C,达到化学反应限度时,B的物质的量可能是( )
2C,达到化学反应限度时,B的物质的量可能是( )