题目内容
7.密闭容器中发上反应:2A(g)+B(g)?xC(g),充分2molA和1molB达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为w%,则x的值为( )| A. | 2或4 | B. | 3或4 | C. | 2或3 | D. | 无法确定 |
分析 恒温恒容下,开始充入2molA和1molB与开始充入0.6molA、0.3molB和1.4molC达到平衡后,C的体积分数为W%,说明为完全等效平衡,按化学计量数转化到左边,满足n(A)=2mol、n(B)=1mol,据此解答.
解答 解:恒温恒容下,开始充入2molA和1molB与开始充入0.6molA、0.3molB和1.4molC达到平衡后,C的体积分数为W%,说明为完全等效平衡,按化学计量数转化到左边,满足n(A)=2mol、n(B)=1mol,故0.6mol+$\frac{2.8}{x}$=2mol,解得x=2,但是对于反应前后气体系数和相等的反应,物质的投料等比即等效,所以x=3也是正确的.
故选C.
点评 本题考查化学平衡计算、等效平衡等,难度中等,恒温恒容,反应前后气体体积不等,按化学计量数转化一边,对应物质满足等量;反应前后气体体积相等,按化学计量数转化一边,对应物质满足等比.

练习册系列答案
相关题目
16. 已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2.
已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2.
(1)请写出括号内物质的化学式CO2;
(2)在其它相同条件下,小组同学通过实验测定不同浓度H2C2O4溶液与等体积等浓度KMnO4溶液混合后,溶液褪色所需的时间.拟定实验数据:
表中①、②处的数据分别是25、5.0;
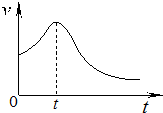
(3)小组同学在处理一系列的实验数据时,发现速率(v)-时间(t)曲线如图所示.他们认为:0~t时
间内,速率变快可能是该反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是生成物作催化剂的影响.
(4)若用实验证明你的猜想,除酸性KMnO4溶液、H2C2O4溶液外,还需要选择的试剂最合理的是MnSO4.
 已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2.
已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2.(1)请写出括号内物质的化学式CO2;
(2)在其它相同条件下,小组同学通过实验测定不同浓度H2C2O4溶液与等体积等浓度KMnO4溶液混合后,溶液褪色所需的时间.拟定实验数据:
| 实验序号 | 温度/℃ | 各物质的体积/mL | 反应时间 | |||
| H2O | 3 mol/L稀硫酸 | 0.1mol/L KMnO4溶液 | 0.6 mol/LH2C2O4溶液 | |||
| 1 | 25 | 3.0 | 2.0 | 4.0 | 6.0 | t1 |
| 2 | 25 | ① | 2.0 | 4.0 | 4.0 | t2 |
| 3 | ② | 7.0 | 2.0 | 4.0 | 2.0 | t3 |
(3)小组同学在处理一系列的实验数据时,发现速率(v)-时间(t)曲线如图所示.他们认为:0~t时
间内,速率变快可能是该反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是生成物作催化剂的影响.
(4)若用实验证明你的猜想,除酸性KMnO4溶液、H2C2O4溶液外,还需要选择的试剂最合理的是MnSO4.
17.进行化学实验必须注意安全,下列说法不正确的是( )
| A. | 为防止试管破裂,加热固体时试管口一般要略高于试管底 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| D. | 酒精灯着火时用湿抹布盖灭 |
2.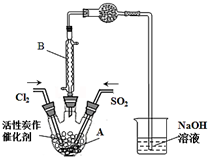 某学习小组依据反应:SO2(g)+Cl2(g?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
(1)若用浓盐酸与二氧化锰为原料制取Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)B仪器的作用是使挥发的产物SO2Cl2冷凝回流.
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择a.
a.冰水浴 b.常温 c.加热至69.1℃
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为SO2+Cl2+2H2O═H2SO4+2HCl.
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收.分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.
①经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式SO2Cl2+2H2O=H2SO4+2HCl.
②无色溶液W中的阴离子除含少量OH-外,还含有其它两种阴离子,检验溶液W中这两种阴离子方法是取少量W溶液于试管中,加入过量Ba(NO3)2溶液,有不溶于稀硝酸的白色沉淀产生,说明溶液中含有SO42-,过滤,向滤液中滴加HNO3酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Cl-.
③反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为xg、yg.计算SO2+Cl2?SO2Cl2反应中,SO2的转化率$\frac{X}{X+Y}$×100%(用含x、y的代数式表示).
 某学习小组依据反应:SO2(g)+Cl2(g?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈 |
(2)B仪器的作用是使挥发的产物SO2Cl2冷凝回流.
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择a.
a.冰水浴 b.常温 c.加热至69.1℃
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为SO2+Cl2+2H2O═H2SO4+2HCl.
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收.分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.
①经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式SO2Cl2+2H2O=H2SO4+2HCl.
②无色溶液W中的阴离子除含少量OH-外,还含有其它两种阴离子,检验溶液W中这两种阴离子方法是取少量W溶液于试管中,加入过量Ba(NO3)2溶液,有不溶于稀硝酸的白色沉淀产生,说明溶液中含有SO42-,过滤,向滤液中滴加HNO3酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Cl-.
③反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为xg、yg.计算SO2+Cl2?SO2Cl2反应中,SO2的转化率$\frac{X}{X+Y}$×100%(用含x、y的代数式表示).
16.向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示下列说法不正确的是( ) 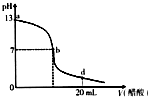

| A. | 该氢氧化钠溶液的物质的量浓度为0.1 mol/L | |
| B. | 在b点,c(Na+)=c(CH3COO-) | |
| C. | 在d点,溶液中所有离子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 氢氧化钠溶液与醋酸溶液恰好完全反应的点位于曲线b、d间的某点 |
17.
(1)硫酸铜与二水合氯化铜溶于水产生天蓝色是阳离子引起的(填阴离子或阳离子),原因是氯化钠、硫酸钾均无色,其实质是铜离子与水分子结合生成了[Cu(H2O)4]2+(用配离子的结构简式表示)
(2)滴加氨水产生蓝色沉淀的原因Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+(用离子方程式表示)
(3)继续滴加氨水产生深蓝色溶液是因为铜离子与氨气分子结合生成了[Cu(NH3)4]2+(用配离子的结构简式表示)
(4)有机物中醛基的检验用的银氨溶液的制备,现象与上述及其相似写出银氨溶液制备过程中所有反应的离子方程式:Ag++NH3.H2O=AgOH↓+NH4+;AgOH+2NH3.H2O=[Ag(NH3)2]++OH-+2H2O.
| 硫酸铜 | 2水合氯化铜 | 硫酸钠 | 氯化钾 | |
| 加水 | 天蓝色 | 天蓝色 | 无色 | 无色 |
| 滴加氨水 | 产生蓝色沉淀 | 产生蓝色沉淀 | 无现象 | 无现象 |
| 继续滴加氨水 | 产生深蓝色溶液 | 产生深蓝色溶液 | 无现象 | 无现象 |
(2)滴加氨水产生蓝色沉淀的原因Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+(用离子方程式表示)
(3)继续滴加氨水产生深蓝色溶液是因为铜离子与氨气分子结合生成了[Cu(NH3)4]2+(用配离子的结构简式表示)
(4)有机物中醛基的检验用的银氨溶液的制备,现象与上述及其相似写出银氨溶液制备过程中所有反应的离子方程式:Ag++NH3.H2O=AgOH↓+NH4+;AgOH+2NH3.H2O=[Ag(NH3)2]++OH-+2H2O.

