��Ŀ����
����Ŀ��NO2��N2O4���ת��2NO2(g)![]() N2O4(g)�Ǹ���������ѧ���ۻ�ѧƽ������ij�����ϵ����ش�
N2O4(g)�Ǹ���������ѧ���ۻ�ѧƽ������ij�����ϵ����ش�
��. ��N2O4 (g)ת��ΪN2O4(l)���������Ʊ����ᡣ
��1����֪2NO2(g)![]() N2O4(g) ��H1 2NO2(g)
N2O4(g) ��H1 2NO2(g)![]() N2O4(l) ��H2
N2O4(l) ��H2
���������仯ʾ��ͼ��ȷ����____________��
A. 
B. 
C. 
��2��NO2��N2O4���ʵ���֮��Ϊ1:1��O2��H2Oǡ����ȫ��Ӧ�Ļ�ѧ����ʽΪ_____��
��. ����2NO2(g)![]() N2O4(g)��Ӧ��ϵ����ƽ�ⳣ��K��=
N2O4(g)��Ӧ��ϵ����ƽ�ⳣ��K��= ������P��Ϊ��ѹǿ(1��105 Pa)��P(N2O4)��P(NO2)Ϊ�����ƽ���ѹ(ƽ���ѹ=��ѹ�����ʵ�����������
������P��Ϊ��ѹǿ(1��105 Pa)��P(N2O4)��P(NO2)Ϊ�����ƽ���ѹ(ƽ���ѹ=��ѹ�����ʵ�����������
��1������ʼNO2�����ʵ�����Ϊ1mol����Ӧ���㶨�¶Ⱥͱ�ѹǿ�½��У�N2O4��ƽ�����Ϊ0.75����K��=____________��
��2�������ִ��ֳּ�������������̽��ѹǿ��2NO2 (g) ![]() N2O4 (g)��ѧƽ���ƶ���Ӱ�졣�ں㶨�¶Ⱥͱ�ѹǿ�����£�����Ͳ�г���һ�������NO2������ܷⲢ���ֻ���λ�ò��䡣�ֱ���t1��t2ʱ��Ѹ���ƶ��������ֻ���λ�ò��䣬�ⶨ��Ͳ������ѹǿ�仯��ͼ��ʾ��
N2O4 (g)��ѧƽ���ƶ���Ӱ�졣�ں㶨�¶Ⱥͱ�ѹǿ�����£�����Ͳ�г���һ�������NO2������ܷⲢ���ֻ���λ�ò��䡣�ֱ���t1��t2ʱ��Ѹ���ƶ��������ֻ���λ�ò��䣬�ⶨ��Ͳ������ѹǿ�仯��ͼ��ʾ��

��B��ʱNO2��ת����Ϊ____________��
��E��H�����Ӧ�����ƽ����Է�������ME __________MH������<��>��=������
��. ��֪��Ӧ��2NO(g)+O2(g)![]() 2NO2(g)��ͨ������������ɵģ�
2NO2(g)��ͨ������������ɵģ�
��Ӧ�٣�2NO(g)![]() N2O2(g) ��H1<0���죩 v1��=k1��c2(NO) v1��=k1��c(N2O2)
N2O2(g) ��H1<0���죩 v1��=k1��c2(NO) v1��=k1��c(N2O2)
��Ӧ�ڣ�N2O2(g)+O2(g)![]() 2NO2(g) ��H2<0������ v2��=k2��c(N2O2)c(O2) v2��=k2��c2(NO2)
2NO2(g) ��H2<0������ v2��=k2��c(N2O2)c(O2) v2��=k2��c2(NO2)
ij����С���������Ӧ�ڵIJ���ʵ���������±���ʾ��
c(N2O2)/ mol/L | c(O2)/ mol/L | ��2��/ mol��L-1��s-1 |
0.010 | 0.010 | 1.75��10-6 |
0.030 | 0.020 | 1.05��10-5 |
x | 0.060 | 1.05��10-5 |
��1�������ϱ��е��й����ݼ��㣺x=________��
��2�����١�������Ӧ�������淴Ӧ���ʳ����ֱ���k1����k2����k2����k2����ʾ����2NO(g)+O2(g)![]() 2NO2(g)��ƽ�ⳣ��K=____�������ʳ�����ʾ������Ӧ�ﵽƽ��������¶ȣ�����ƽ�⽨��ǰ����ϵ��c(N2O2)�Ĵ�С�仯��������_____��
2NO2(g)��ƽ�ⳣ��K=____�������ʳ�����ʾ������Ӧ�ﵽƽ��������¶ȣ�����ƽ�⽨��ǰ����ϵ��c(N2O2)�Ĵ�С�仯��������_____��
���𰸡�B 4NO2+4N2O4+3O2+6H2O==12HNO3 3.75 6% < 0.010 ��k1����k2����/��k1����k2���� ��С
��������
��.(1)��NO2(g)ת��ΪN2O4(g)�ķ�ӦΪ���ȷ�Ӧ��ͬ��������̬ʱ������Һ̬ʱ�����ߣ�
(2)NO2��N2O4���ʵ���֮��Ϊ1:1��O2��H2Oǡ����ȫ��Ӧ�������ᣬֻҪ��ϵ����غ��ԭ���غ㼴��д����Ӧ�Ļ�ѧ����ʽ��
��. (1) 2NO2(g)![]() N2O4(g)
N2O4(g)
��ʼ���ʵ���(mol) 1 0
�仯���ʵ���(mol) 0.75 0.375
ƽ�����ʵ���(mol) 0.25 0.375
ƽ��ʱNO2���������Ϊ![]() =0.4��N2O4���������Ϊ
=0.4��N2O4���������Ϊ![]() =0.6���ٽ��K��=
=0.6���ٽ��K��=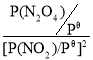 ���ɣ�
���ɣ�
(2)�ٸ��ݰ����ӵ����ɣ�������������ʱ��ѹǿ֮�ȵ������ʵ���֮�ȣ��������ʽ�����м��㣻
�ڽ��ƽ����ƶ�����������������ʵ����仯���ж�ƽ����Է��������ı仯��
��. (1)����v2��=k2��c(N2O2)c(O2)���㼴�ɣ�
(2)��Ӧ�ﵽƽ��״̬����v1��=v1����v2��=v2����2NO(g)+O2(g)2NO2(g)��ƽ�ⳣ��K=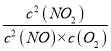 ���ݴ����㣻�¶����ߣ�ƽ�������ȷ�Ӧ�����ƶ���
���ݴ����㣻�¶����ߣ�ƽ�������ȷ�Ӧ�����ƶ���
��.(1)��NO2(g)ת��ΪN2O4(g)�ķ�ӦΪ���ȷ�Ӧ����N2O4(g)ת��ΪN2O4(l)ҲΪ���ȷ�Ӧ��������ͼ���и÷�Ӧ�ķ�Ӧ�������������������������ߣ�ͬ��������̬��Һ̬��ų���������Һ̬ʱ��������̬ʱ�����ͣ���N2O4(l)���е�������N2O4(g)���е������ͣ�ͼ��B���ϣ��ʴ�ΪB��
(2)NO2��N2O4���ʵ���֮��Ϊ1:1��O2��H2Oǡ����ȫ��Ӧ�������ᣬ�����غ㷨�÷�����Ӧ�Ļ�ѧ����ʽΪ4NO2+4N2O4+3O2+6H2O==12HNO3��
��.(1) 2NO2(g)![]() N2O4(g)
N2O4(g)
��ʼ���ʵ���(mol) 1 0
�仯���ʵ���(mol) 0.75 0.375
ƽ�����ʵ���(mol) 0.25 0.375
ƽ��ʱNO2���������Ϊ![]() =0.4��N2O4���������Ϊ
=0.4��N2O4���������Ϊ![]() =0.6�����ƽ�ⳣ��K��=
=0.6�����ƽ�ⳣ��K��=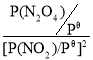 =
=![]() =3.75��
=3.75��
(2)�ٸ��ݰ����ӵ����ɣ��¶ȣ��������ʱ��ѹǿ֮�ȵ������ʵ���֮�ȡ�����ʼʱNO2�����ʵ���Ϊn����Ӧ�����ʵ���Ϊ2x���г�����ʽ��
2NO2 N2O4
��ʼ/mol n 0
��Ӧ/mol 2x x
ƽ��/mol n-2x x
���ʵ���֮�ȵ���ѹǿ֮�ȣ���![]() =
=![]() ��x=
��x=![]() ��NO2��ת����Ϊ
��NO2��ת����Ϊ![]() ��100%=
��100%=![]() ��100%=6%��
��100%=6%��
��E��Hѹǿ����ƽ�������ƶ�������������ʵ�����С������M=![]() ��֪�����ƽ��Ħ��������������ƽ����Է�������ME��MH��
��֪�����ƽ��Ħ��������������ƽ����Է�������ME��MH��
��. (1)��֪v2��=k2��c(N2O2)c(O2)�����ݱ������ݿ�֪��v2��=k2��c(N2O2)c(O2)=k2����0.030��0.020=k2����x��0.060����ã�x=0.010��
(2)��Ӧ�ﵽƽ��״̬����v1��=v1����v2��=v2������k1��c2(NO)=k1��c(N2O2)��k2��c(N2O2)c(O2)=k2��c2(NO2)������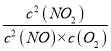 =
=![]() ��2NO(g)+O2(g)2NO2(g)��ƽ�ⳣ��K=
��2NO(g)+O2(g)2NO2(g)��ƽ�ⳣ��K=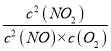 =
=![]() ����Ӧ�١��ھ�Ϊ���ȷ�Ӧ�������¶�ƽ��������ƶ�����Ӧ�ﵽƽ��������¶ȣ�����ƽ�⽨��ǰ����ϵ��c(N2O2)�Ĵ�С�仯��������С��
����Ӧ�١��ھ�Ϊ���ȷ�Ӧ�������¶�ƽ��������ƶ�����Ӧ�ﵽƽ��������¶ȣ�����ƽ�⽨��ǰ����ϵ��c(N2O2)�Ĵ�С�仯��������С��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����ͼ��Ԫ�����ڱ���һ���֣���Ҫ��ش����⣺
�� | �� | ||||||||||||||||
�� | �� | �� | �� | �� | �� | �� | �� | ||||||||||
�� | �ޡ� | �� | �� | �� | �� | �� | �� | �� | �� | �� | �� | �� | �� | �� | �ࡡ | �� | �� |
(1)Ԫ�آ������ڱ���λ����_______��Ԫ�آ۵����������Ļ�ѧʽΪ________��
(2)Ԫ�آ٢���ɻ��������ʽΪ___________��
(3)Ԫ�آڵĵ�����������������ˮ�����ȵ�Ũ��Һ��Ӧ�Ļ�ѧ����ʽΪ___��
(4)Ԫ�آ�����γɵĻ�������Ԫ�آ۵��⻯���ˮ��Һ��Ӧ�����ӷ���ʽΪ_____��
(5)Ԫ�آܢݢޢ��γɵļ����ӣ������Ӱ뾶��С�����˳��Ϊ_____(�����ӷ��ű�ʾ)��
(6)A��F������ͼ��ʾ��ת����A��B��C��DΪ��������ij��Ԫ���γɵĵ��ʣ�E��F��GΪB��C��D��A�γɵĶ�Ԫ�����G��һ�ֳ����������壬��B���Է�Ӧ����E��E��BԪ�ص���������Ϊ60%��FΪ�������ʡ�

��A��F�Ļ�ѧʽ�ֱ�Ϊ_______��_______��
��B��G��Ӧ�Ļ�ѧ����ʽΪ____________________��
��C��NaOH��Һ��Ӧ�����ӷ���ʽΪ______________��





