题目内容
【题目】如图是元素周期表的一部分,按要求回答问题:
① |
| ||||||||||||||||
|
|
| ② | ③ | ④ |
|
| ||||||||||
⑤ | ⑥ |
|
|
|
|
|
|
|
|
|
| ⑦ |
|
| ⑧ | ⑨ |
|
(1)元素④在周期表中位置是_______。元素③的最高价氧化物的化学式为________。
(2)元素①⑤组成化合物电子式为___________。
(3)元素②的单质与⑧的最高价氧化物的水化物热的浓溶液反应的化学方程式为___。
(4)元素⑦与⑨形成的化合物与元素③的氢化物的水溶液反应的离子方程式为_____。
(5)元素④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为_____(用离子符号表示)。
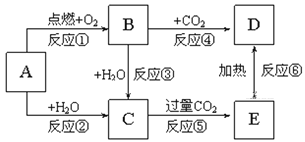
(6)A—F发生如图所示的转化,A、B、C、D为①—⑨中某种元素形成的单质,E、F、G为B、C、D与A形成的二元化合物,G是一种常见温室气体,与B可以反应生成E,E中B元素的质量分数为60%,F为两性物质。
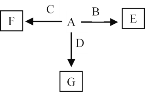
①A和F的化学式分别为_______、_______。
②B与G反应的化学方程式为____________________。
③C与NaOH溶液反应的离子方程式为______________。
【答案】第二周期第VIA族 N2O5 ![]() C+2H2SO4(浓)
C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O Al3++3NH3H2O=Al(OH)3↓+3NH4+ Mg2+<Na+<O2-<S2- O2 Al2O3 2Mg+CO2
CO2↑+2SO2↑+2H2O Al3++3NH3H2O=Al(OH)3↓+3NH4+ Mg2+<Na+<O2-<S2- O2 Al2O3 2Mg+CO2![]() 2MgO+C 2Al+2OH-+6H2O=2[Al(OH)]4-+3H2↑
2MgO+C 2Al+2OH-+6H2O=2[Al(OH)]4-+3H2↑
【解析】
结合元素周期表可知①为H元素,②为C元素,③为N元素,④为O元素,⑤为Na元素,⑥为Mg元素,⑦为Al元素,⑧为S元素,⑨为Cl元素。
(1)④为O元素,在周期表中位置是第二周期第VIA族,③是N元素,最高价为+5价,所以元素③的最高价氧化物的化学式为N2O5;
(2)元素①⑤组成化合物为NaH,属于离子化合物,Na+的电子式为Na+,H-的电子式为![]() ,因而NaH的电子式为
,因而NaH的电子式为![]() ;
;
(3)元素②的单质与⑧的最高价氧化物的水化物分别是C和H2SO4,其化学反应方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
(4)元素⑦与⑨形成的化合物与元素③的氢化物分别是AlCl3和NH3,NH3的水溶液为NH3·H2O,其离子方程式为Al3++3NH3H2O=Al(OH)3↓+3NH4+;
(5)元素④⑤⑥⑧形成的简单离子分别是O2-,Na+,Mg2+,S2-,S2-的电子层数为3,其它离子电子层数为2,所以S2-的半径最大;当电子层数相同时,原子序数越小,离子半径越大,因而O2->Na+>Mg2+;综上可知Mg2+<Na+<O2-<S2-;
(6)G是一种常见温室气体,可推知G为CO2,结合A、B、C、D为①—⑨中某种元素形成的单质,且A和D生成G,推断A为O2或C(碳单质),F为两性物质且F为C与A形成的二元化合物,可推知F为Al2O3,因而A为O2,D为C(碳单质),C为Al;E中B元素的质量分数为60%,结合E为B与A形成的二元化合物,E中O元素的质量分数为40%,则E的相对分子质量为![]() ,则B元素的相对原子质量为40-16=24,可推知B为Mg,E为MgO,结合G是一种常见温室气体,与B可以反应生成E,即CO2与Mg点燃生成MgO和C,证明上述推断合理;综上A为为O2,B为Mg,C为Al;D为C(碳单质),E为MgO,F为Al2O3,G为CO2。
,则B元素的相对原子质量为40-16=24,可推知B为Mg,E为MgO,结合G是一种常见温室气体,与B可以反应生成E,即CO2与Mg点燃生成MgO和C,证明上述推断合理;综上A为为O2,B为Mg,C为Al;D为C(碳单质),E为MgO,F为Al2O3,G为CO2。
①由上分析知A和F的化学式分别为O2,Al2O3;
②B与G反应,即Mg与CO2![]() 2MgO+C;
2MgO+C;
③C为Al,则C与NaOH溶液反应的离子方程式2Al+2OH-+6H2O=2[Al(OH)]4-+3H2↑。

【题目】NO2和N2O4的相互转化2NO2(g)![]() N2O4(g)是高中乃至大学讨论化学平衡问题的常用体系。请回答:
N2O4(g)是高中乃至大学讨论化学平衡问题的常用体系。请回答:
Ⅰ. 将N2O4 (g)转化为N2O4(l),可用来制备硝酸。
(1)已知2NO2(g)![]() N2O4(g) △H1 2NO2(g)
N2O4(g) △H1 2NO2(g)![]() N2O4(l) △H2
N2O4(l) △H2
下列能量变化示意图正确的是____________。
A. 
B. 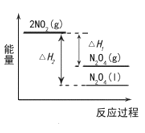
C. 
(2)NO2和N2O4物质的量之比为1:1与O2和H2O恰好完全反应的化学方程式为_____。
Ⅱ. 对于2NO2(g)![]() N2O4(g)反应体系,标准平衡常数Kθ=
N2O4(g)反应体系,标准平衡常数Kθ= ,其中Pθ为标准压强(1×105 Pa),P(N2O4)和P(NO2)为各组分平衡分压(平衡分压=总压×物质的量分数)。
,其中Pθ为标准压强(1×105 Pa),P(N2O4)和P(NO2)为各组分平衡分压(平衡分压=总压×物质的量分数)。
(1)若起始NO2的物质的量设为1mol,反应在恒定温度和标准压强下进行,N2O4的平衡产率为0.75,则Kθ=____________。
(2)利用现代手持技术传感器可以探究压强对2NO2 (g) ![]() N2O4 (g)化学平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。
N2O4 (g)化学平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。

①B点时NO2的转化率为____________。
②E、H两点对应气体的平均相对分子质量ME __________MH(填“<、>或=”)。
Ⅲ. 已知反应:2NO(g)+O2(g)![]() 2NO2(g)是通过下面两步完成的:
2NO2(g)是通过下面两步完成的:
反应①:2NO(g)![]() N2O2(g) △H1<0(快) v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
N2O2(g) △H1<0(快) v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
反应②:N2O2(g)+O2(g)![]() 2NO2(g) △H2<0(慢) v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
2NO2(g) △H2<0(慢) v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
某科研小组测量出反应②的部分实验数据如下表所示:
c(N2O2)/ mol/L | c(O2)/ mol/L | ν2正/ mol·L-1·s-1 |
0.010 | 0.010 | 1.75×10-6 |
0.030 | 0.020 | 1.05×10-5 |
x | 0.060 | 1.05×10-5 |
(1)根据上表中的有关数据计算:x=________。
(2)若①、②两反应的正、逆反应速率常数分别用k1正、k2逆、k2正、k2逆表示,则2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K=____(用速率常数表示);反应达到平衡后升高温度,在新平衡建立前,体系内c(N2O2)的大小变化趋势是逐渐_____。
2NO2(g)的平衡常数K=____(用速率常数表示);反应达到平衡后升高温度,在新平衡建立前,体系内c(N2O2)的大小变化趋势是逐渐_____。