题目内容
【题目】某化学小组研究盐酸被氧化的条件,进行如下实验。
(1)研究盐酸被MnO2氧化。
实验 | 操作 | 现象 |
Ⅰ | 常温下将MnO2和12mol/L浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
Ⅱ | 将I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
Ⅲ | 加热MnO2和4mol/L稀盐酸混合物 | 无明显现象 |
① I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是________。
② Ⅱ中发生了分解反应,反应的化学方程式是________。
③ Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验IV进行探究:
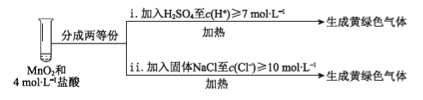
将实验Ⅲ、Ⅳ作对比,得出的结论是________;将实验现象Ⅳ中的ⅰ、ⅱ作对比,得出的结论是_______。
(2)研究盐酸能否被氧化性酸氧化。
① 烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象。由此得出浓硫酸____(填“能”或“不能”)氧化盐酸。
② 向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2。
实验 | 操作 | 现象 |
Ⅰ | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
Ⅱ | 将湿润的淀粉KI试纸伸入Cl2中 | 试纸先变蓝,后褪色 |
Ⅲ | …… | 试纸先变蓝,不褪色 |
通过实验I、Ⅱ、Ⅲ证明混合气体中含有Cl2,Ⅲ的操作是________。
【答案】 MnO2+4HCl=MnCl4+2H2O MnC14![]() Cl2↑+MnCl2 Ⅲ中没有明显现象的原因是c(H+)、c(Cl-)较低,需要增大到一定浓度才能被MnO2氧化 MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-) 不能 将湿润的淀粉KI试纸伸入纯净的NO2中
Cl2↑+MnCl2 Ⅲ中没有明显现象的原因是c(H+)、c(Cl-)较低,需要增大到一定浓度才能被MnO2氧化 MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-) 不能 将湿润的淀粉KI试纸伸入纯净的NO2中
【解析】(1)①MnO2与浓盐酸发生了复分解反应,因此反应的化学方程式为MnO2+4HCl=MnCl4+2H2O;②将Ⅰ中混合物过滤得到滤液成分为MnCl4、HCl,加热滤液,发生了分解反应,生成大量黄绿色气体,即有氯气生成,所以反应的化学方程式为MnCl4 ![]() Cl2↑ + MnCl2;③由实验IV可知c(H+)或c(Cl-)需要增大到一定浓度时盐酸才能被MnO2氧化,故III中没有明显现象的原因是c(H+)、c(Cl-)较低,需要增大到一定浓度才能被MnO2氧化;④i中滴加浓H2SO4至c(H+)>7mol/L时生成黄绿色气体氯气,说明HCl的还原性与c(H+)有关;ii中中滴加固体氯化钠至c(Cl-) >10mol/L时生成黄绿色气体氯气,说明HCl的还原性与c(Cl-)有关,因此可以得出的结论是MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-);(2)①根据实验现象“用湿润的淀粉KI试纸检验,无明显现象”,说明Cl-并未被浓硫酸氧化,由此得出浓硫酸不能氧化盐酸;②证明混合气体中含有Cl2,需要用Cl2、NO2作对比实验,故操作III为湿润的淀粉KI试纸伸入纯净的NO2中,观察现象即可。
Cl2↑ + MnCl2;③由实验IV可知c(H+)或c(Cl-)需要增大到一定浓度时盐酸才能被MnO2氧化,故III中没有明显现象的原因是c(H+)、c(Cl-)较低,需要增大到一定浓度才能被MnO2氧化;④i中滴加浓H2SO4至c(H+)>7mol/L时生成黄绿色气体氯气,说明HCl的还原性与c(H+)有关;ii中中滴加固体氯化钠至c(Cl-) >10mol/L时生成黄绿色气体氯气,说明HCl的还原性与c(Cl-)有关,因此可以得出的结论是MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-);(2)①根据实验现象“用湿润的淀粉KI试纸检验,无明显现象”,说明Cl-并未被浓硫酸氧化,由此得出浓硫酸不能氧化盐酸;②证明混合气体中含有Cl2,需要用Cl2、NO2作对比实验,故操作III为湿润的淀粉KI试纸伸入纯净的NO2中,观察现象即可。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案