题目内容
【题目】氨气、尿素[CO(NH2)2]、Na2CO3均是重要的化工原料和产品,如图是某化工厂联合生成氨气、尿素[CO(NH2)2]、纯碱的部分工艺流程图. 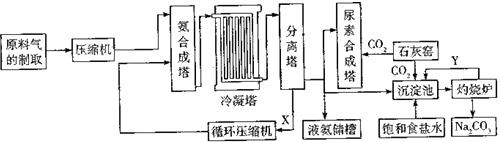
(1)原料气进入压缩机前需要进行净化处理,其目的是 . 制备氨合成塔的材料(填“能”或“不能”)使用普通的碳素钢.
(2)N2、H2混合气体经压缩后再送入氨合成塔,优点是 . 某整个生产中循环使用某些原料可提高生产效益,能循环利用的物质是 .
(3)请按要求填写下列空白.
①沉淀池中的离子方程式: .
②生产尿素的化学方程式: .
(4)在较低温度下,可从沉淀池的溶液中分离出一种副产品由此可推断,低温下NH4C1的溶解度很可能(填“小于”或“大于”)NaCL.NH4C1是一种氮肥,但长期施用易使土壤酸化,用离子方程式表示其原因 .
(5)以焦炭、水为原料制备H2 (碳转化为CO2 , 则1000g纯度为a%((杂质不与水反应)焦炭最多可制备g尿素(已知合成氨时h2的利用率为b%、合成尿素时NH3的利用率为c%)
【答案】
(1)防止催化剂中毒影响催化活性;不能
(2)提高反应速率和转化率;N2、CO2、H2
(3)Na++H2O+NH3+CO2=NaHCO3↓+NH4+;2NH3+CO2 ![]() ?[CO(NH2)2]+H2O
?[CO(NH2)2]+H2O
(4)小于;NH4++H2O?H++NH3?H2O
(5)![]()
【解析】解:(1)原料气中的一些物质能使催化剂中毒,故要通过净化除去,氨合成塔中的反应是在高压下进行的,制备合成塔的材料需要承受较高的压力,所以普通的碳素钢不能制成该合成塔,所以答案是:防止催化剂中毒影响催化活性;不能;(2)混合气体经压缩后,可以增大反应物的浓度,提高反应的速率,由于合成氨的反应是气体分子数减少的反应,所以高压有利于提高原料的转化率,循环使用某些原料可提高生产效益,能循环利用的物质是N2、CO2、H2;所以答案是:提高反应速率和转化率;N2、CO2、H2;(3)①沉淀池中析出的固体是溶解度较小的碳酸氢钠,发生反应的离子方程式:Na++H2O+NH3+CO2=NaHCO3↓+NH4+;所以答案是:Na++H2O+NH3+CO2=NaHCO3↓+NH4+;②氨气和二氧化碳在加热加压条件下可以得到尿素,生产尿素的化学方程式为:2NH3+CO2 ![]() [CO(NH2)2]+H2O,所以答案是:2NH3+CO2
[CO(NH2)2]+H2O,所以答案是:2NH3+CO2 ![]() [CO(NH2)2]+H2O;(4)在沉淀池中还有氯化钠和氯化铵,低温下氯化铵可以结晶析出,但是氯化钠不能,所以低温下氯化铵的溶解度很可能小于氯化钠,NH4C1是一种氮肥,但铵根离子水解显示酸性,所以长期施用易使土壤酸化,离子方程式表示为:NH4++H2OH++NH3H2O;所以答案是:小于;NH4++H2OH++NH3H2O;(5)根据相关反应结合元素守恒,得到关系式为:C﹣2H2﹣
[CO(NH2)2]+H2O;(4)在沉淀池中还有氯化钠和氯化铵,低温下氯化铵可以结晶析出,但是氯化钠不能,所以低温下氯化铵的溶解度很可能小于氯化钠,NH4C1是一种氮肥,但铵根离子水解显示酸性,所以长期施用易使土壤酸化,离子方程式表示为:NH4++H2OH++NH3H2O;所以答案是:小于;NH4++H2OH++NH3H2O;(5)根据相关反应结合元素守恒,得到关系式为:C﹣2H2﹣ ![]() NH3﹣
NH3﹣ ![]() [CO(NH2)2],得到n(C)=
[CO(NH2)2],得到n(C)= ![]() ,所以尿素的物质的量是)=
,所以尿素的物质的量是)= ![]() ×
× ![]() ×b%×c%,所以质量为:
×b%×c%,所以质量为: ![]() ×
× ![]() ×b%×c%×60g=
×b%×c%×60g= ![]() g,所以答案是:
g,所以答案是: ![]() .
.