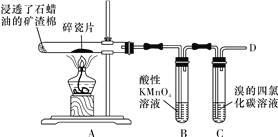
��Ŀ����
����Ŀ������a��i 9�ֶ�����Ԫ�أ�������ͬ�ڱ��е�λ�����£���ݴ˻ش���������:(���þ����Ԫ�ط��ż���ѧ��������)
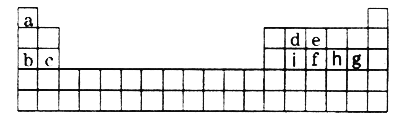
��1��a��iԪ���У���������ǿ����________������������Ӧˮ�����У�������ǿ��������___________��g�������Ԫ���γɵ��⻯���зе���͵���____________________��
��2���Ƚ�b��e��g�����Ӱ뾶�Ĵ�С___________________(�����ӷ�������)��
��3��д����a��i 9��Ԫ���е�ijЩԪ���γɣ�������ԭ�Ӷ����������Ϊ8���ӽṹ���������ֻ�����Ļ�ѧʽ__________________��___________________��
��4����һ����ѧ��Ӧ����ʽ��ʾd�ķǽ�����ǿ��i_______________________________��
��5�����������ڱ���λ�������Ԫ��������������������������ڱ��е�һ��������Ѱ���µ����ʡ����������ڱ�������ͷǽ����Ľ��紦�ҵ��˰뵼����ϡ�
�����е����У��������뵼����ϵ�������______(�����)��
A.Si B.Ge C.S
����(As)��e��ͬ��Ԫ�أ��ϱ�e��2�����Ӳ㣬���һ�ֺ��غ���42�����ӣ��ú��صķ���_________����(Ga)��Asͬ���ڣ��������3�����ӣ�Ga��As�����γ�һ�����ͻ�����뵼����ϣ������ܸ���Խ���������ͻ����ﻯѧʽΪ____________________��
��6��c��a�γɵĻ�����ĵ���ʽΪ___________���õ���ʽ��ʾa��h�γ�a2h�Ĺ���__________________________________________��
��7���������ڱ��Խ��߷�����Be��Al���ʼ��������������ơ���д��Be������������Һ��Ӧ�����ӷ���ʽ_________________________________��
���𰸡� Na HClO4 HCl Cl->N3->Na+ CCl4 PCl3 CO2+H2O+Na2SiO3=H2SiO3��+Na2CO3 C 7533As GaAs ![]()
![]() Be+2OH-=BeO22-+H2��
Be+2OH-=BeO22-+H2��
������������������a��i 9�ֶ�����Ԫ����ͬ�ڱ��е�λ�ÿ�֪�ֱ���H��Na��Mg��C��N��P��Cl��S��Si�����Ԫ�������ɡ��й����ʵ����ʺ�����������
��⣺�������Ϸ�����֪a��i�ֱ���H��Na��Mg��C��N��P��Cl��S��Si����
��1��ͬ�����������ҽ�����������ͬ������ϵ��½���������ǿ����a��iԪ���У���������ǿ����Na���ǽ�����Խǿ����ۺ����������Խǿ��������������Ӧˮ�����У�������ǿ��������HClO4��g����Ԫ�أ��������Ԫ���γɵ��⻯��е���ԭ����������������ߵ���������HF���γ�������е���ߣ���е���͵���HCl��
��2��������Ӳ���Խ�࣬���Ӱ뾶Խ��������Ų���ͬʱ���Ӱ뾶��ԭ���������������С����b��e��g�����Ӱ뾶�Ĵ�СΪCl->N3->Na+��
��3����a��i 9��Ԫ���е�ijЩԪ���γɣ�������ԭ�Ӷ����������Ϊ8���ӽṹ���������ֻ�����Ļ�ѧʽ��CS2��NCl3��CCl4��PCl3�ȡ�
��4��̼�����Ʊ����ᣬ˵��̼Ԫ�طǽ�����ǿ�ڹ裬��ѧ��Ӧ����ʽΪCO2+H2O+Na2SiO3��H2SiO3��+Na2CO3��
��5����Si��Geλ�ڽ����ͷǽ����Ľ��紦�������뵼����ϣ������������뵼����ϣ���ѡC��
����(As)��e��ͬ��Ԫ�أ��ϱ�e��2�����Ӳ㣬��������7+8+18��33�����һ�ֺ��غ���42�����ӣ���������33+42��75����˸ú��صķ���Ϊ![]() ����(Ga)��Asͬ���ڣ��������3�����ӣ�Ga��As�����γ�һ�����ͻ�����뵼����ϣ����ϼ۷ֱ���+3�ۺͣ�3�ۣ�����������ͻ����ﻯѧʽΪGaAs��
����(Ga)��Asͬ���ڣ��������3�����ӣ�Ga��As�����γ�һ�����ͻ�����뵼����ϣ����ϼ۷ֱ���+3�ۺͣ�3�ۣ�����������ͻ����ﻯѧʽΪGaAs��
��6��c��a�γɵĻ����������ӻ�����MgH2������ʽΪ![]() ��a��h�γɵ�a2h�ǹ��ۻ�����H2S�����õ���ʽ��ʾa��h�γ�a2h�Ĺ���Ϊ
��a��h�γɵ�a2h�ǹ��ۻ�����H2S�����õ���ʽ��ʾa��h�γ�a2h�Ĺ���Ϊ![]() ��
��
��7���������ڱ��Խ��߷�����Be��Al���ʼ��������������ƣ��������������������Һ��Ӧ�ķ���ʽ���ƿɵó�Be������������Һ��Ӧ�����ӷ���ʽΪBe+2OH-��BeO22-+H2����

 ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д�����Ŀ���ס��ҡ��������������������У��ס��ҡ����о�����ij����ͬ��Ԫ�أ�����֮���������ͼ��ʾת����ϵ����Ӧ���������ֲ�������ȥ���������й����ʵ��ƶϲ���ȷ����
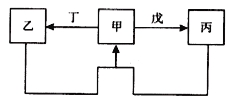
ѡ�� | ���� | ���� |
A | ��ΪS | ����������� |
B | ��ΪAl(OH)3 | ������������������Һ |
C | ��ΪFe | ������������ |
D | ��ΪNa2CO3��Һ | �������CO2 |
A. A B. B C. C D. D