题目内容
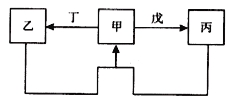
【题目】甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如下图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是
选项 | 假设 | 结论 |
A | 甲为S | 戊可能是氧气 |
B | 甲为Al(OH)3 | 丁可能是氢氧化钠溶液 |
C | 甲为Fe | 丁可能是硝酸 |
D | 甲为Na2CO3溶液 | 戊可能是CO2 |
A. A B. B C. C D. D
【答案】C
【解析】A.S与O2反应生成SO2, S与H2反应生成H2S, SO2与H2S发生归中反应生成S,A正确;B. Al(OH)3为两性氢氧化物,可与酸、碱反应生成AlO2-、Al3+,AlO2-、Al3+可以发生双水解反应生成Al(OH)3,B正确; C.甲为铁,乙为可能为Fe(NO3)2或Fe(NO3)3,丙可能为FeCl3或FeCl2等,Fe2+ 和Fe3+不能发生反应生成Fe,C错误;D.甲为Na2CO3溶液,可与CO2反应生成碳酸氢钠,与氢氧化钙反应生成NaOH,氢氧化钠和碳酸氢钠反应生成碳酸钠,D正确;答案选C。

【题目】氯气是氯碱工业的主要产品之一,常作强氧化剂,可与有机物和无机物进行反应生成多种氯化物。某兴趣小组在实验室中对以下反应进行了探究。回答下列问题:
Ⅰ、三氯化硼(BCl3)的制备,已知:①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃; ②2B+6HCl ![]() 2BCl3↑+3H2↑。
2BCl3↑+3H2↑。

(1)按气流方向连接各装置的接口,顺序为a→( )→( )→( )→( )→( )→( )→f→g→h。_________
(2)装置D的作用是_____________;实验中若不用装置C,可能产生的危险是____________。
(3)BCl3遇水发生水解观察到大量的白雾,生成两种酸,其反应的化学方程式为:___________。
Ⅱ、SO2与漂粉精溶液的反应
操作 | 现象 |
取4g 漂粉精固体,加入100mL 水,测漂粉精溶液的pH | pH 试纸先变蓝(约为12),后褪色 |
| 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀,黄绿色褪去 |
(4)pH试纸颜色的变化说明漂粉精溶液具有的性质是_____________________________。
(5)现象2中溶液变为黄绿色的原因是:随溶液酸性的增强,漂粉精的有效成分和Cl- 发生反应。该反应的离子方程式为________________________。
(6)用离子方程式解释现象3中黄绿色褪去的原因_______________________。