题目内容
【题目】下面是石蜡油在炽热碎瓷片的作用下产生乙烯并检验其性质的实验,完成下列问题。
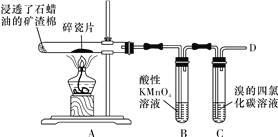
(1)A中碎瓷片的作用是____________。
(2)乙烯的电子式为__________________。
(3)下列物质中,可以通过乙烯的加成反应得到的是______(填字母代号)。
A.CH3CH3 B.CH3CHCl2
C.CH3CH2OH D.CH3CH2Br
(4)运输水果时,为了吸收水果产生的乙烯,防止水果早熟腐烂,常将浸泡有_______溶液的硅藻土放置在盛放水果的容器中。
【答案】 催化剂 ![]() ACD 高锰酸钾(或KMnO4)
ACD 高锰酸钾(或KMnO4)
【解析】分析:石蜡在碎瓷片的作用下发生裂解生成乙烯,B用于检验乙烯,乙烯可与高锰酸钾发生氧化还原反应而使高锰酸钾溶液褪色,C用于检验乙烯发生加成反应的性质,结合乙烯的结构和性质分析解答。
详解:(1)由题意:石蜡油在炽热碎瓷片的作用下产生乙烯,可知其作用主要是催化剂,加快反应速率;
(2)乙烯分子中含有碳碳双键,电子式为![]() ;
;
(3)A.乙烯与氢气发生加成反应生成CH3CH3,A正确;
B.CH3CHCl2不能通过乙烯的加成反应得到,B错误;
C.乙烯与水发生加成反应生成CH3CH2OH,C正确;
D.乙烯与溴化氢发生加成反应生成CH3CH2Br,D正确,答案选ACD。
(4)酸性高锰酸钾溶液能吸收乙烯,因此运输水果时,为了吸收水果产生的乙烯,防止水果早熟腐烂,常将浸泡有酸性高锰酸钾溶液的硅藻土放置在盛放水果的容器中。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。请回答下列问题:
① | ② | ③ | |||||||||||||||
④ | ⑤ | ⑥ | ⑦ | ||||||||||||||
⑧ | ⑨ | ⑩ |
(1)⑥元素在周期表中的位置是第______周期______族;
(2)上表①~⑩十种元素中金属性最强的是______,非金属性最强的是______;(填元素符号)
(3)用电子式写出表中元素④原子与元素⑦原子形成化合物的过程________________;
(4)写出③元素的氢化物与⑩元素的氢化物反应生成盐的电子式__________;
(5)写出③元素的最高价氧化物对应的水化物的稀溶液与过量的元素⑨单质反应的离子方程式_________________________________;
(6)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与元素⑧的最高价氧化物对应的水化物的溶液反应的化学方程式:______________________________________________。