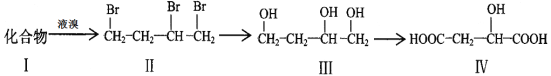
题目内容
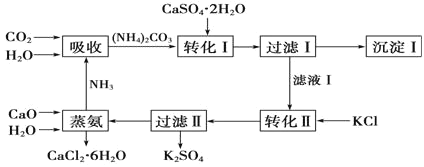
【题目】石膏转化为硫酸钾和CaCl2的工艺流程如图:
![]()
(1)CO2是一种很重要的副产品,工业上获得CO2的途径是___(用化学方程式表示)。
(2)过滤Ⅰ得到的滤液是___,检验滤液中含有CO32-的方法__。
(3)转化Ⅱ中发生反应的化学方程式为___,转化Ⅱ中可获得K2SO4的原因是__。
(4)氯化钙结晶水合物是目前常用的无机储热材料,选择的依据是___。
a.熔点较低(29℃熔化) b.能制冷
c.无毒 d.能导电
(5)废水中氨氮(主要以NH4+和NH3形式存在)的去除常见的有生物脱氮法和电解法。而电解法产生的强氧化物质HClO也可将氨氮转化为氮气而除去,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性溶液来模拟。阳极的电极反应式___,处理1mol(NH4)2SO4,需要消耗HClO物质的量是___mol。
【答案】CaCO3![]() CaO+CO2↑ (NH4)2SO4 取少量滤液于试管中,滴加稀HCl,若有无色无味能使澄清石灰水变浑浊的气体产生,则证明滤液中含有CO32-,若无明显现象,则滤液中不含CO32- 2KCl+(NH4)2SO4=K2SO4↓+2NH4Cl KCl、(NH4)2SO4、K2SO4、NH4Cl四种物质的溶解度受温度的影响不同 a c H2O+Cl—2e-=HClO+H+ 3mol
CaO+CO2↑ (NH4)2SO4 取少量滤液于试管中,滴加稀HCl,若有无色无味能使澄清石灰水变浑浊的气体产生,则证明滤液中含有CO32-,若无明显现象,则滤液中不含CO32- 2KCl+(NH4)2SO4=K2SO4↓+2NH4Cl KCl、(NH4)2SO4、K2SO4、NH4Cl四种物质的溶解度受温度的影响不同 a c H2O+Cl—2e-=HClO+H+ 3mol
【解析】
碳酸铵和硫酸钙反应生成硫酸铵和碳酸钙,将碳酸钙过滤后溶液中加入氯化钾,得到硫酸钾固体,再过滤,溶液为氯化铵,加入氧化钙和水,得到氨气和氯化钙。
(1)工业上用煅烧石灰石的方法得到二氧化碳,反应方程式为: CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
(2)碳酸铵和硫酸钙反应生成碳酸钙沉淀和硫酸铵,所以过滤后的滤液为 (NH4)2SO4 ;
利用碳酸根离子能和酸反应生成二氧化碳,二氧化碳能使澄清石灰水变浑浊进行实验,实验操作为:取少量滤液于试管中,滴加稀HCl,若有无色无味能使澄清石灰水变浑浊的气体产生,则证明滤液中含有CO32-,若无明显现象,则滤液中不含CO32- ;
(3).从流程分析,加入氯化钾,析出硫酸钾,所以反应方程式为:2KCl+(NH4)2SO4=K2SO4↓+2NH4Cl;因为 KCl、(NH4)2SO4、K2SO4、NH4Cl四种物质的溶解度受温度的影响不同,所以硫酸钾随着温度变化较大,能控制温度变化使其析出;
(4)储热材料说明可以吸收热量,这说明化合物的熔点较低,易吸热熔化,从而可以降低周围环境的温度,同时化合物应该是无毒的,对人体健康没有伤害。故选a、c;
(5)根据题中信息,氯离子在阳极电子生成次氯酸,故电极反应为H2O+Cl—2e-=HClO+H+,根据化合价分析,铵根离子的氮元素化合价从-3升高到0,次氯酸中的氯元素化合价从+1降低到-1,根据得失电子数相等分析,硫酸铵和次氯酸的比例为1:3,故处理1mol(NH4)2SO4,需要消耗HClO物质的量是3mol。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案【题目】现有五种元素,其中A、B、C为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等 |
B元素原子的核外p电子数比s电子数少1 |
C原子第一至第四电离能如下: I1=738 kJ·mol-1,I2=1451 kJ·mol-1,I3=7733 kJ·mol-1,I4=10540 kJ·mol-1 |
F是前四周期中电负性最小的元素 |
G在周期表的第八列 |
(1)已知BA5为离子化合物,写出其电子式:________。
(2)B元素基态原子中能量最高的电子,其电子云在空间有______个方向,原子轨道呈____形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为![]() ,该同学所画的电子排布图违背了___________________________________。
,该同学所画的电子排布图违背了___________________________________。
(4)G位于第____族____区,该元素的核外电子排布式为_____________________。该二价离子很容易被氧化成三价离子,从原子轨道理论解释原因________________________
(5)检验F元素的方法是___,请用原子结构的知识解释产生此现象的原因: ______。
【题目】A~G是短周期主族元素,原子序数依次增大。它们的部分信息如下表所示:
A | B | C | D | E | F | G | |
原子半径/nm | 0.077 | 0.074 | 0.186 | 0.143 | 0.099 | ||
主要化合价 | -4,+4 | -2 | +3 | -4,+4 | -1,+7 | ||
其它 | 阳离子核外无电子 | 它的化合物数量众多分布极广 | 焰色反应呈黄色 | 无机非金属材料的主角 |
(1)F在元素周期表中的位置是____________;
(2)任写一个BA4的同系物的分子式___________;
(3)请用电子式表示DG的形成过程____________;
(4)元素D与C按原子个数比1∶1形成的化合物所含的化学键有______(填化学键类型);
(5)D与E相比,金属性较强的是_____(用元素符号表示),元素D、E最高价的氧化物对应的水化物反应的离子方程式为___________
(6)工业上冶炼单质E的化学方程式为_______。