题目内容
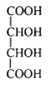
【题目】[物质结构与性质](1)酒石酸钛配合物广泛应用于药物合成。酒石酸(结构如图所示)中羧基氧原子的轨道杂化类型分别是______________
(2)氰酸(HOCN)的结构式是_________,根据等电子体原理,可推测氰酸根离子的空间构型是____。
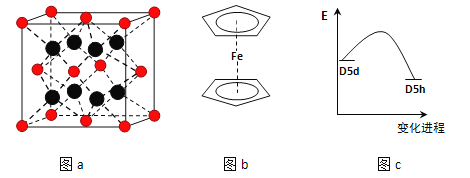
(3)FeBr2为只含有离子键的离子化合物,其晶胞结构如图a,距一个Fe2+离子最近的所有Br-离子为顶点构成的几何体为_____________.
(4)二茂铁是最重要的金属茂基配合物,也是最早被发现的夹心配合物,包含两个环戊二烯基与铁原子成键.二茂铁的结构为一个铁原子处在两个平行的环戊二烯基环的之间,结构如图b所示,已知二茂铁的一氯代物只有一种.
①二茂铁的分子式为__________.
②穆斯堡尔谱学数据显示,二茂铁中心铁原子的氧化态为+2,每个茂环带有一个单位负电荷.因此每个环含有________个π电子.
③二茂铁中两个茂环可以是重叠的(D5h),也可以是错位的(D5d),它们之间的能垒仅有8~20kJ/mol.温度升高时则绕垂直轴相对转动,使得两种结构可以相互转换,转换过程中能量变化如图c.比较稳定的是__________结构(填“重叠”或“错位”).
(5)氧化镍(NiO)是一种纳米材料,比表面积S(m2/g)是评价纳米材料的重要参数之一(纳米粒子按球形计)。基态Ni2+有_________个未成对电子,已知氧化镍的密度为ρg/cm3;其纳米粒子的直径为Dnm列式表示其比表面积 ____________m2/g。
【答案】sp2H-O-C≡N直线型立方体C10H10Fe6重叠26000/Dρ
【解析】
(1)羧基的结构简式为![]() ,两个O原子的价层电子对数分别为3、4,则杂化类型分别为sp2、sp3;
,两个O原子的价层电子对数分别为3、4,则杂化类型分别为sp2、sp3;
(2)碳为四配位,氮为三配位,氧为两配位,故氰酸(HOCN)的结构式是N≡C-O-H;氰酸(HOCN)的结构式是N≡C-O-H,中心原子碳原子价层电子对个数=σ键个数+孤电子对个数=2+![]() (4-2×2)=2,采取sp杂化;CNO-电子数为22,与CNO-互为等电子体微粒为CO2,CO2是直线型分子,等电子体的结构相似,所以CNO-的空间构型是直线型;
(4-2×2)=2,采取sp杂化;CNO-电子数为22,与CNO-互为等电子体微粒为CO2,CO2是直线型分子,等电子体的结构相似,所以CNO-的空间构型是直线型;
(3)距一个阴离子周围最近的所有阳离子为顶点构成的几何体是立方体;
(4)①因为包含两个环戊二烯基与铁原子,又环戊二烯基为-C5H5,所以二茂铁的分子式为C10H10Fe;
②因为每个环戊二烯中含有5个C原子,在加上铁原子的一个电子,所以每个环含有的π电子数为6;
③由图象知,D5h的能量较低,所以比较稳定的是重叠结构;
(5)Ni的原子序数为28,电子排布式为1s22s22p63s23p63d84s2,基态Ni2+核外电子排布式为1s22s22p63s23p63d8,3d有8个电子,其中2个单电子;其纳米粒子的直径为Dnm=D×10-7m,表面积为4π(![]() ×10-7)2cm2=4π(
×10-7)2cm2=4π(![]() ×10-7)2×10-4 m2=4π(
×10-7)2×10-4 m2=4π(![]() ×10-7)2×10-4 m2=πD2×10-18m2,体积为
×10-7)2×10-4 m2=πD2×10-18m2,体积为![]() π(
π(![]() ×10-7)3cm3,纳米粒子的质量为
×10-7)3cm3,纳米粒子的质量为![]() π(
π(![]() ×10-7)3cm3×ρg/cm3=
×10-7)3cm3×ρg/cm3=![]() π(
π(![]() ×10-7)3×ρg=
×10-7)3×ρg=![]() g,比表面积为
g,比表面积为![]() =6000/Dρ。
=6000/Dρ。

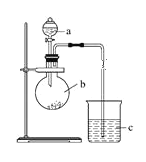
【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
a(干燥气体) | b(液体) |
| |
A | NO | 水 | |
B | CO2 | 饱和NaHCO3溶液 | |
C | Cl2 | 饱和NaCl溶液 | |
D | NH3 | 1 mol·L-1盐酸 |
A.AB.BC.CD.D