��Ŀ����
����Ŀ��ƻ������ƻ�����е���Ҫ�������ʡ��������Ի������Ϊԭ�Ϻϳ�ƻ���ᣨ�����ĺϳ�·�ߡ�

�ش��������⣺
��1������������ɻ������ķ�Ӧԭ�������ʿɴ�100%���������Ľṹ��ʽΪ__________________��
��2��ƻ������������������ŵ�������_____________________________________��
��3��д�����������л������ת���ɻ������ķ�Ӧ������____________________��
��4����������ж���ͬ���칹�壬�����뻯����������������ͬ��ֻ��һ�����Ĺ��� ____�֣��������������
��5�������ϳ�·�����漰�ķ�Ӧ������____________________________��
a���ӳɷ�Ӧ b��������Ӧ c��ȡ����Ӧ d����ȥ��Ӧ e����ԭ��Ӧ
��6��д��ƻ������������������Ʒ�Ӧ�Ļ�ѧ����ʽ___________________________��
���𰸡�BrCH2CH=CH2 �ǻ� �Ȼ� ����������Һ������ 5 abc ![]()
��������
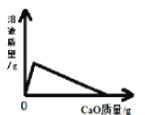
����������ɻ������ķ�Ӧԭ�������ʿɴ�100%����I��Һ�巢���ӳɷ�Ӧ����II������II�ṹ��ʽ֪��IΪCH2��CHCH2CH2Br��II����ˮ�ⷴӦ����III��III����������Ӧ����IV��
(1)����������ɻ������ķ�Ӧԭ�������ʿɴ�100%��˵���÷�ӦΪ�ӳɷ�Ӧ����II�����ƶ�I��
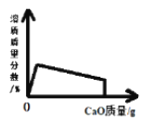
(2)ƻ�����к����ǻ����Ȼ���
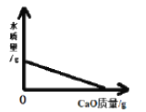
(3)±������ȡ����Ӧ��ҪNaOHˮ��Һ�ͼ��������²��ܷ�����
(4)��������ж���ͬ���칹�壬�����뻯����������������ͬ��˵������̼̼˫������ԭ�ӣ���ֻ��һ������
(5)�ɷ�Ӧǰ��ṹ�仯ȷ����Ӧ���ͣ�
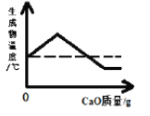
(6)�Ȼ����ǻ����ܺ��Ʒ�Ӧ����������
(1)ͨ�����Ϸ���֪��I�ṹ��ʽΪCH2��CHCH2CH2Br��
(2)ƻ������������������ŵ��������ǻ����Ȼ���
(3)�������ת���ɻ��������±������ˮ�ⷴӦ����Ҫ��NaOH��ˮ��Һ�м��Ƚ��У����Ը÷�Ӧ�ķ�Ӧ����������������Һ�����ȣ�
(4)I�ṹ��ʽΪCH2��CHCH2CH2Br����������ж���ͬ���칹�壬�����뻯����������������ͬ��˵��������ԭ�Ӻ�̼̼˫������ֻ��һ���������̼���ṹΪC��C��C��C����Brֻ�ܷ��ڼ��ϣ���1�֣����̼���ṹΪ![]() ����Br���ڼ��ϣ���1�֣����̼���ṹΪC��C��C��C����3�֣���Br���ܷ��ڼ��ϣ���3�֣��������������5�֣�
����Br���ڼ��ϣ���1�֣����̼���ṹΪC��C��C��C����3�֣���Br���ܷ��ڼ��ϣ���3�֣��������������5�֣�
(5)I��IIΪ�ӳɷ�Ӧ��II��IIIΪˮ�ⷴӦ��ȡ����Ӧ��III��IVΪ������Ӧ�������ϳ�·�����漰�ķ�Ӧ�����мӳɷ�Ӧ��ȡ����Ӧ��������Ӧ���ʴ�Ϊabc��
(6)ƻ����������ǻ����Ȼ�������Na��Ӧ������������ƻ���������������Ʒ�Ӧ�Ļ�ѧ����ʽ![]() ��
��

 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�����Ŀ�������仯��������Ҫ�ҹ㷺��Ӧ��
(1)��̬Fe2+�ļ۲���ӵĹ����ʾʽΪ_____________
(2)����Fe3+������KSCN��Һ��д��SCN-��һ�ֵȵ��������_______��
(3)���ֵ������������±���
Ԫ�� | Mn | Fe | |
������(kJ/mol) |
| 717 | 759 |
| 1 509 | 1 561 | |
| 3 248 | 2 957 | |
���ݱ������ݿ�֪����̬Mn2+ ��ʧȥһ�����ӱ���̬Fe2+ ��ʧȥһ�������ѣ���ԭ����_______________________________________________________
(4)���ɽ���ԭ�ӿ�����CO�����γ����������۵�������������18���ӹ���������Cr������CO�γ�Cr(CO)6 ���ӣ��۵�������(18)= Cr�ļ۵�����(6)+CO�ṩ������(2��6)��Feԭ��Ҳ����CO�γ������仯ѧʽΪ________��
(5)FeS2����ľ�����ͼ��ʾ�������߳�Ϊa nm��FeS2���ʽ��ΪM�������ӵ�������ֵΪNA���侧���ܶȵļ������ʽΪ___________g��cm3��