题目内容
【题目】初中化学常见物质A-I分别是下列物质中的一种:锌、氢氧化钠、硫酸铜溶液、稀盐酸、碳酸钠溶液、石灰水、生石灰、石灰石和水。他们之间相互的反应(每种物质只能用一次)恰好包含了化合反应(A+B)、分解反应(C)、置换反应(D+E)、中和反应(F+G)、复分解反应(H+I)等反应类型。试回答下列问题:
(1)A+B的反应化学方程式是______________________。
(2)C的化学式为___________;硫酸铜溶液参加___________反应(填反应类型)。
(3)H+I的反应方程式是_________________________________。
【答案】CaO+H2O =Ca(OH)2 CaCO3 置换 Na2CO3+Ca(OH)2=CaCO3![]() +2NaOH
+2NaOH
【解析】
化合反应为两种或两种以上物质反应生成一种化合物的反应;分解反应为一个物质反应生成两种或两种以上物质的反应;复分解反应为由两种化合物互相交换成分,生成另外两种化合物的反应;置换反应为一种单质和一种化合物生成另外一种单质和化合物的反应。
(1)所有物质中能发生化合反应的是氧化钙与水的反应,反应方程式为CaO+H2O =Ca(OH)2。
(2)所有物质中能发生分解反应的是碳酸钙,则C为CaCO3;硫酸铜与锌发生置换反应。
(3)氢氧化钠与稀盐酸发生中和反应,因为每种物质只能用一次,故发生复分解反应的是碳酸钠与氢氧化钙,反应方程式为Na2CO3+Ca(OH)2=CaCO3![]() +2NaOH。
+2NaOH。

【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题
(1)Z元素在周期表中的位置为__________。
(2)元素周期表中与Z元素同周期原子半径最大的是(写元素名称)__________,其最高价氧化物对应的水化物含有的化学键类型____________。
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)根据下图实验,可以证明碳的非金属性比X强。饱和小苏打溶液的作用__________。发生的离子方程式是:__________________
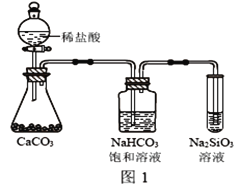
(5)重水(D2O)是重要的核工业原料,下列说法错误的是________。
a.氘(D)原子核内有1个中子
b.1H与D互称同位素
c.H2O与D2O互称同素异形体
d.1H218O与D216O的相对分子质量相同