题目内容
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质是一种重要的半导体材料。下列说法中,正确的是( )
| A.X、Y、Z、W的原子半径和原子序数都依次增大 |
| B.W、Z、M元素的气态氢化物热稳定性依次增强 |
| C.M分别和Y、Z所形成化合物都可以和碱反应 |
| D.X分别和M、W所形成的化合物含化学键类型一定相同 |
C
解析试题分析:由X、Y、Z、W、M为五种短周期元素,及X+与M2-具有相同的电子层结构,可以推出X为你金属钠元素,M为氧元素,又因Z、M同主族,故Z为硫元素;Y的单质是一种重要的半导体材料,Y为硅元素;因X、Y、Z、W同周期,且离子半径:Z2->W-故W为氯元素。
考点:考查基本理论,元素周期律

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
表示一个原子在第三电子层上有10个电子可以写成
| A.310 | B.3d10 | C.3s23p63d2 | D.3s23p64s2 |
随着卤素原子半径的增大,下列递变规律正确的是
| A.单质熔、沸点逐渐降低 | B.气态氢化物稳定性逐渐增强 |
| C.卤素离子的还原性逐渐增强 | D.元素的非金属性逐渐增强 |
已知33As、34Se、35Br位于同一周期,下列关系正确的是
| A.电负性:As>Cl>P | B.热稳定性:HCl>HBr>AsH3 |
| C.第一电离能:Br>Se>As | D.酸性:H3AsO4>H2SO4>H3PO4 |
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4,下列说法正确的是( )
| A.W、X、Y、Z的原子半径大小顺序是:W>X>Y>Z |
| B.Y的最高价氧化物对应水化物的酸性比Z的最高价氧化物对应水化物的酸性更强 |
| C.Y和Z形成的分子的空间构型可能是正四面体 |
| D.工业上用电解熔融的X和Z两元素组成的化合物来制取X的单质 |
下列有关原子结构或元素性质说法正确的是
| A.原子核外电子排布式为1s2的元素与原子核外电子排布式为1s22s2的元素化学性质相似 |
B.基态碳原子的价电子排布图: |
C.基态铜原子的价电子排布图: |
| D.Fe3+的最外层电子排布式为:3s23p63d5 |
X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是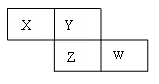
| A.气态氢化物的稳定性:X>Y |
| B.Z元素的氧化物对应的水化物一定是一种强酸 |
| C.X、Y、Z原子半径的大小顺序: X>Y>Z |
| D.X的气态氢化物与W的气态氢化物可以相互反应 |
