题目内容
利用所学化学反应原理,解决以下问题:
(1)某溶液含两种相同物质的量的溶质,溶液中只存在OH-、H+、NH4+、Cl-四种离子,且c(NH4+)>c(Cl-)>c(OH-)>c(H+),则这两种溶质是______.
(2)0.1mol?L-1的氨水与0.05mol?L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性:______.
(3)以石墨电极电解100mL0.1mol?L-1CuSO4溶液.若阳极上产生气体的物质的量为0.01mol,则阴极上析出Cu的质量为______g.
(4)将AgCl分别放入①5mLH2O②10mL0.2mol?L-1MgCl2③20mL0.5mol?L-1NaCl溶液④40mL0.1mol?L-1HCl中溶解至饱和,各溶液中Ag+的浓度由大到小的顺序是______.
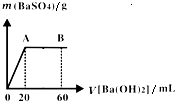
(5)向20mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如图所示,B点溶液的pH=7(忽略溶液体积变化),则c(HCl)=______mol?L-1.
(1)某溶液含两种相同物质的量的溶质,溶液中只存在OH-、H+、NH4+、Cl-四种离子,且c(NH4+)>c(Cl-)>c(OH-)>c(H+),则这两种溶质是______.
(2)0.1mol?L-1的氨水与0.05mol?L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性:______.
(3)以石墨电极电解100mL0.1mol?L-1CuSO4溶液.若阳极上产生气体的物质的量为0.01mol,则阴极上析出Cu的质量为______g.
(4)将AgCl分别放入①5mLH2O②10mL0.2mol?L-1MgCl2③20mL0.5mol?L-1NaCl溶液④40mL0.1mol?L-1HCl中溶解至饱和,各溶液中Ag+的浓度由大到小的顺序是______.
(5)向20mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如图所示,B点溶液的pH=7(忽略溶液体积变化),则c(HCl)=______mol?L-1.

(1)溶液中只存在OH-、H+、NH4+、Cl-四种离子,离子的关系可知溶液显碱性,且c(NH4+)>c(Cl-),溶液含两种相同物质的量的溶质,则溶液为氯化铵和氨水的混合溶液,一水合氨电离大于水解,溶液呈碱性;其溶质为NH4Cl、NH3.H2O,
故答案为:NH4Cl和NH3?H2O;
(2)二者完全反应生成硫酸铵,铵根离子水解,溶液呈酸性,反应的实质为NH4++H2O?NH3?H2O+H+,故答案为:NH4++H2O?NH3?H2O+H+;
(3)以惰性电极电解100mL0.1mol?L-1CuSO4溶液,阳极发生4OH--4e-═2H2O+O2↑,阴极发生2Cu2++4e-═2Cu,
由O2↑~2Cu,
1 2
0.01mol 0.02mol
但n(CuSO4)=0.1L×0.1mol/L=0.01mol,
即Cu完全析出,则阴极上析出Cu的质量为0.01mol×64g/mol=0.64g;
胡答案为:0.64;
(4)饱和溶液中Ksp(AgCl)=c(Ag+)×c(Cl-),溶液中c(Cl-)越大,则c(Ag+)越小,题中c(Cl-)大小顺序为③>②>④>①则Ag+的浓度由大到小的排列顺序是:①>④>②>③,
故答案为:①>④>②>③;
(5)c(Ba(OH)2)=
×c(OH-)=0.05mol/L,整个过程发生反应分别为:SO42-+Ba2+=BaSO4↓,以及H++OH-=H2O,
由图象可知:n(H2SO4)=n(Ba(OH)2)=0.05mol/L×0.02L=0.001mol,
加入Ba(OH)2溶液60mL时酸碱恰好完全中和,
则有:2×n(H2SO4)+0.02L×c(HCl)=0.06L×0.1mol/L,
c(HCl)=
=0.2mol/L,
故答案为:0.2.
故答案为:NH4Cl和NH3?H2O;
(2)二者完全反应生成硫酸铵,铵根离子水解,溶液呈酸性,反应的实质为NH4++H2O?NH3?H2O+H+,故答案为:NH4++H2O?NH3?H2O+H+;
(3)以惰性电极电解100mL0.1mol?L-1CuSO4溶液,阳极发生4OH--4e-═2H2O+O2↑,阴极发生2Cu2++4e-═2Cu,
由O2↑~2Cu,
1 2
0.01mol 0.02mol
但n(CuSO4)=0.1L×0.1mol/L=0.01mol,
即Cu完全析出,则阴极上析出Cu的质量为0.01mol×64g/mol=0.64g;
胡答案为:0.64;
(4)饱和溶液中Ksp(AgCl)=c(Ag+)×c(Cl-),溶液中c(Cl-)越大,则c(Ag+)越小,题中c(Cl-)大小顺序为③>②>④>①则Ag+的浓度由大到小的排列顺序是:①>④>②>③,
故答案为:①>④>②>③;
(5)c(Ba(OH)2)=
| 1 |
| 2 |
由图象可知:n(H2SO4)=n(Ba(OH)2)=0.05mol/L×0.02L=0.001mol,
加入Ba(OH)2溶液60mL时酸碱恰好完全中和,
则有:2×n(H2SO4)+0.02L×c(HCl)=0.06L×0.1mol/L,
c(HCl)=
| 0.06L×0.1mol/L-2×0.001mol |
| 0.02L |
故答案为:0.2.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目