题目内容
【题目】用0.1 mol·L1的盐酸滴定20 mL约0.1 mol·L1氨水,滴定曲线如图所示,下列说法正确的是
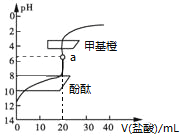
A. a点溶液中:c(H+)=c(OH)+c(NH3·H2O)
B. 滴定过程中,当溶液的pH=7时,两者恰好中和
C. 用酚酞作指示剂比用甲基橙作指示剂,滴定误差更小
D. 当滴入盐酸为30 mL时,溶液中:c(NH4+)+c(H+)<c(OH)+c(Cl)
【答案】A
【解析】A.a点时恰好中和生成氯化铵,物料守恒式为c(NH4+)+c(NH3H2O)=c(Cl-),电荷守恒式为c(NH4+)+c(H+)=c(OH-)+c(Cl-),则c(H+)=c(OH-)+c(NH3H2O),故A正确;B.两者恰好中和时生成氯化铵,溶液的pH<7,当溶液的pH=7时,氨水未完全反应,故B错误;C.反应终点生成氯化铵,水解显酸性,酚酞的变色范围为8~10,应选甲基橙作指示剂,即用酚酞作指示剂比用甲基橙作指示剂,滴定误差更大,故C错误;D.溶液不显电性,遵循电荷守恒,则当滴入盐酸达30mL时,溶液中c(NH4+)+c(H+)=c(OH-)+c(Cl-),故D错误;故选A。

【题目】[化学-选修3:物质结构与性质]
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的。青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素。
(1)硅元素基态原子的价电子轨道表示式为____________。
(2)第四周期中,与铝未成对电子数相同的金属元素有________种。
(3)Na+和Ne互为等电子体,电离能I2(Na)________I1(Ne)(填“>”或“<”)。
(4)①已知氯有多种含氧酸,其电离平衡常数如下:
化学式 | HClO4 | HClO3 | HClO2 | HClO |
Ka | 1×1010 | 1×101 | 1×10-2 | 4×10-8 |
HClO4的结构简式为_________,HClO3中Cl原子的杂化轨道类型为________,HClO2中含有的共价键类型为__________。以上几种含氧酸的酸性强弱不同,其原因为______________。
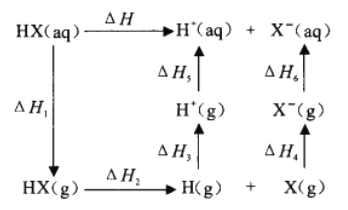
②氢卤酸(HX)的电离过程如图。ΔH1和ΔH2的递变规律都是HF>HCl>HBr>HI,其中ΔH1(HF)特别大的原因为_________,影响ΔH2递变的因素为______________。
(5)铝单质为面心立方晶体,晶胞参数a=q nm,铝的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA。则铝单质的密度为________g·cm-3(列式即可,下同),铝晶胞中原子的体积占晶胞体积的百分率为____________。