题目内容
【题目】[化学-选修3:物质结构与性质]
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的。青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素。
(1)硅元素基态原子的价电子轨道表示式为____________。
(2)第四周期中,与铝未成对电子数相同的金属元素有________种。
(3)Na+和Ne互为等电子体,电离能I2(Na)________I1(Ne)(填“>”或“<”)。
(4)①已知氯有多种含氧酸,其电离平衡常数如下:
化学式 | HClO4 | HClO3 | HClO2 | HClO |
Ka | 1×1010 | 1×101 | 1×10-2 | 4×10-8 |
HClO4的结构简式为_________,HClO3中Cl原子的杂化轨道类型为________,HClO2中含有的共价键类型为__________。以上几种含氧酸的酸性强弱不同,其原因为______________。
②氢卤酸(HX)的电离过程如图。ΔH1和ΔH2的递变规律都是HF>HCl>HBr>HI,其中ΔH1(HF)特别大的原因为_________,影响ΔH2递变的因素为______________。

(5)铝单质为面心立方晶体,晶胞参数a=q nm,铝的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA。则铝单质的密度为________g·cm-3(列式即可,下同),铝晶胞中原子的体积占晶胞体积的百分率为____________。
【答案】 ![]() 4 >
4 > ![]() sp3 σ键和
sp3 σ键和![]() 键 氯的含氧酸中非烃基氧原子数目越多,中心氯原子价态越高,正电性越高,导致Cl—O—H中的电子更向Cl偏移,越易电离出H+ HF的水溶液中存在氢键作用 原子半径(或键长或键能)
键 氯的含氧酸中非烃基氧原子数目越多,中心氯原子价态越高,正电性越高,导致Cl—O—H中的电子更向Cl偏移,越易电离出H+ HF的水溶液中存在氢键作用 原子半径(或键长或键能) 
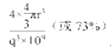
【解析】(1)硅为第14号元素,在周期表第三周期第ⅣA,硅的价电子轨道表示式为![]() ;
;
(2)Al的未成对电子数为1,第四周期中未成对电子数为1的有K[Ar]4s1、Se[Ar]3d14s2、Cu[Ar]3d104s1、Ga[Ar]3d104s24p1、Br[Ar]3d104s24p5、其中金属元素有4种;
(3)Na+和Ne电子层结构均为两层饱和结构,Na+质子数为11,大于Ne的质子数,因此对最外层电子的吸引力Na>Ne,所以电离能I2(Na)>I1(Ne);
(4)①根据含氧酸的结构特点,HClO4的结构简式为![]() ,ClO3-中Cl原子的价层电子对数为3+
,ClO3-中Cl原子的价层电子对数为3+![]() =4,没有孤电子对,故其杂化轨道形成为sp3,HClO2的结构式为H—O—Cl=O,共价键类型为极性共价键(或σ键和
=4,没有孤电子对,故其杂化轨道形成为sp3,HClO2的结构式为H—O—Cl=O,共价键类型为极性共价键(或σ键和![]() 键);氯的含氧酸中非烃基氧原子数目越多,中心氯原子价态越高,正电性越高,导致Cl—O—H中的电子更向Cl偏移,越易电离出H+,酸性越强,故酸性:HClO<HClO2<HClO3<HClO4。
键);氯的含氧酸中非烃基氧原子数目越多,中心氯原子价态越高,正电性越高,导致Cl—O—H中的电子更向Cl偏移,越易电离出H+,酸性越强,故酸性:HClO<HClO2<HClO3<HClO4。
②ΔH1表示液态卤化氢气化:HX(aq)→HX(g),吸收的能量;气化需要克服分子间作用力,由于氟化氢分子间有氢键,所以分子间作用力大熔沸点高,气化所吸收的能量高ΔH1特别大,ΔH2表示卤化氢分解成原子,HX(g)→H(g)+X(g)是破坏共价键的过程,因此影响ΔH2递变的因素:从上到下原子半径越大,键长越小,越容易分解,ΔH2越小;
(5)Al是面心立方晶胞,平均占有的Al原子数为4个,根据密度公式:ρ=![]() g/cm3,因此原子体积为4个球体的体积,占体积百分比=
g/cm3,因此原子体积为4个球体的体积,占体积百分比=![]() ×100%=
×100%=![]() 。
。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案



