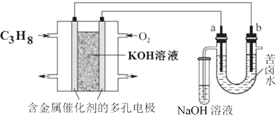
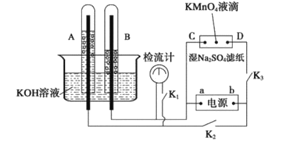
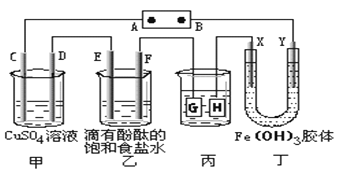
题目内容
【题目】铁在热的稀![]() 中反应,其主要还原产物为
中反应,其主要还原产物为![]() ,而在冷的稀
,而在冷的稀![]() 中反应,其主要还原产物为NO,当溶液更稀时,其还原产物为
中反应,其主要还原产物为NO,当溶液更稀时,其还原产物为![]() 。请分析如图,回答有关问题。
。请分析如图,回答有关问题。
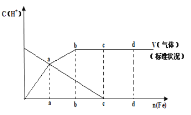
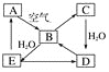
![]() 假设在任一气体产生的曲线段内只有一种还原产物,试配平由b点到c点时的化学反应方程式:_____Fe+____HNO3—____Fe(NO3)3+_________+____H2O
假设在任一气体产生的曲线段内只有一种还原产物,试配平由b点到c点时的化学反应方程式:_____Fe+____HNO3—____Fe(NO3)3+_________+____H2O
![]() 判断从o点到a点时的还原产物,应是___________
判断从o点到a点时的还原产物,应是___________
![]() 点到b点时产生还原产物为_________,其原因是______________
点到b点时产生还原产物为_________,其原因是______________
![]() 已知达到d点时反应完全结束,此时溶液中的主要阳离子为____________。
已知达到d点时反应完全结束,此时溶液中的主要阳离子为____________。
【答案】8 30 8 ![]() 9
9 ![]()
![]() 反应放热,温度升高
反应放热,温度升高 ![]() 、
、![]()
【解析】
图像从题给条件知铁在冷稀![]() 中生成NO,开始为冷稀硝酸,所以从o点到a点时的还原产物为 NO,反应放热,随反应进行温度升高,a点到b点还原产物为
中生成NO,开始为冷稀硝酸,所以从o点到a点时的还原产物为 NO,反应放热,随反应进行温度升高,a点到b点还原产物为![]() ,bc段气体总体积不再增大,b点到c点时还原产物为
,bc段气体总体积不再增大,b点到c点时还原产物为![]() ,c点到d点为铁与硝酸铁生成硝酸亚铁,据此分析。
,c点到d点为铁与硝酸铁生成硝酸亚铁,据此分析。
![]() 从题给条件知铁在冷稀
从题给条件知铁在冷稀![]() 中生成NO,开始为冷稀硝酸,所以从o点到a点时的还原产物为 NO,反应放热,随反应进行温度升高,a点到b点还原产物为
中生成NO,开始为冷稀硝酸,所以从o点到a点时的还原产物为 NO,反应放热,随反应进行温度升高,a点到b点还原产物为![]() ,bc段气体总体积不再增大,b点到c点时还原产物为
,bc段气体总体积不再增大,b点到c点时还原产物为![]() ,根据得失电子数相等得出反应的化学方程式为
,根据得失电子数相等得出反应的化学方程式为![]()
![]()
![]()
![]()
答案:8;30;8;![]() ;9;
;9;
![]() 由以上分析可知,o点到a点时的还原产物为NO;
由以上分析可知,o点到a点时的还原产物为NO;
答案:NO;
![]() 反应放热,温度升高,所以a点到b点时的还原产物为
反应放热,温度升高,所以a点到b点时的还原产物为![]() ;
;
答案:![]() ;反应放热,温度升高;
;反应放热,温度升高;
![]() 段
段 ![]() 耗尽,无气体产生,Fe与
耗尽,无气体产生,Fe与![]() 反应生成
反应生成![]() ,d点时反应完全结束,此时溶液中的主要阳离子是
,d点时反应完全结束,此时溶液中的主要阳离子是![]() 、
、![]() ;
;
答案:![]() 、
、![]() 。
。

【题目】三硫化四磷用于制造火柴等,可由白磷和单质硫化合而得。它们的结构如下:

依据下列键能数据,反应8P4(s)+3S8(s)=8P4S3(g)的ΔH为( )
化学键 | P—P | S—S | P—S |
键能/kJ·mol-1 | a | b | c |
A.24(a+b-2c) kJ·mol-1B.(32a+24b-24c) kJ·mol-1
C.(48c-24a-24b) kJ·mol-1D.(8a+3b-3c) kJ·mol-1