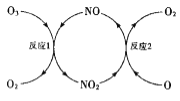
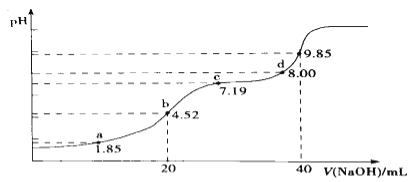
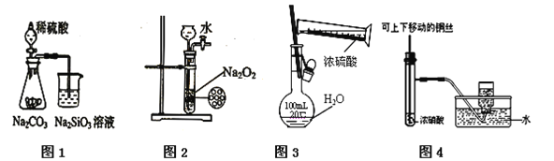
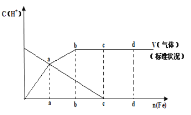
��Ŀ����
����Ŀ���ڹ�ҵ�ϳ�����ʱ����![]() ��
��![]() ��ԭ�Ͻ���������
��ԭ�Ͻ���������
![]() ��ͼΪ�ϳɰ���Ӧ�������������������Ϊ1��3Ͷ��ʱ��ͬ�¶Ⱥ�ѹǿ��ʹ����ͬ���������£�ƽ�������а����������ͼ��
��ͼΪ�ϳɰ���Ӧ�������������������Ϊ1��3Ͷ��ʱ��ͬ�¶Ⱥ�ѹǿ��ʹ����ͬ���������£�ƽ�������а����������ͼ��
![]() ���ֱ���
���ֱ���![]() ��
��![]() ��ʾ�ӷ�Ӧ��ʼ����ƽ��״̬A��Bʱ�Ļ�ѧ��Ӧ���ʣ���
��ʾ�ӷ�Ӧ��ʼ����ƽ��״̬A��Bʱ�Ļ�ѧ��Ӧ���ʣ���![]() ______
______ ![]() ����
����![]() ������
������![]() ������
������![]() ��
��![]() ��
��
![]() ��
��![]() ��
��![]() �£�
�£�![]() ��ת����Ϊ
��ת����Ϊ
______ ![]() ����������С�����1λ
����������С�����1λ![]() ��
��
![]() ��
��![]() ��ˮ��
��ˮ��![]() ������������ϣ�����Ӧ������Һ�Լ��ԣ���Ӧ���Һ�и�����Ũ���ɴ�С��˳��Ϊ ______ ��
������������ϣ�����Ӧ������Һ�Լ��ԣ���Ӧ���Һ�и�����Ũ���ɴ�С��˳��Ϊ ______ ��
![]() ��
��![]() ����������Ӧ�������أ�������Ӧ�������仯ʾ��ͼ���£�
����������Ӧ�������أ�������Ӧ�������仯ʾ��ͼ���£�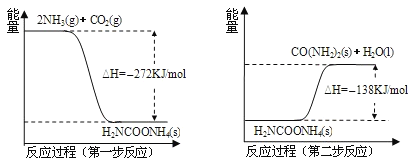
![]() ��
��![]() ��Ӧ�������ص��Ȼ�ѧ����ʽΪ ______ ��
��Ӧ�������ص��Ȼ�ѧ����ʽΪ ______ ��
![]() ��ҵ�Ϻϳ�����ʱ�����ܼӿ췴Ӧ���ʣ��������ԭ�������ʵĴ�ʩ�� ______
��ҵ�Ϻϳ�����ʱ�����ܼӿ췴Ӧ���ʣ��������ԭ�������ʵĴ�ʩ�� ______ ![]() �����
�����![]()
A.�����¶� ![]() �������
������� ![]() �����ؼ�ʱ�����ȥ
�����ؼ�ʱ�����ȥ ![]() ����Ӧ��ϵ��ѹǿ
����Ӧ��ϵ��ѹǿ
![]() ijʵ��С��ģ�ҵ�Ϻϳ����ص���������һ���Ϊ
ijʵ��С��ģ�ҵ�Ϻϳ����ص���������һ���Ϊ![]() ���ܱ�������Ͷ��4mol����1mol������̼��ʵ���÷�Ӧ�и������ʱ��ı仯��ͼ��ʾ��
���ܱ�������Ͷ��4mol����1mol������̼��ʵ���÷�Ӧ�и������ʱ��ı仯��ͼ��ʾ��
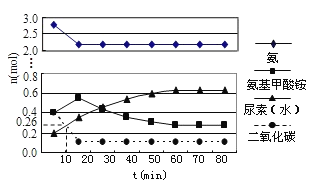
![]() ��֪�ܷ�Ӧ������ͨ��������һ����Ӧ��������ϳ������ܷ�Ӧ�������ɵ� ______ ����Ӧ������
��֪�ܷ�Ӧ������ͨ��������һ����Ӧ��������ϳ������ܷ�Ӧ�������ɵ� ______ ����Ӧ������
![]() ��Ӧ���е�10minʱ���
��Ӧ���е�10minʱ���![]() �����ʵ�����ͼ��ʾ������
�����ʵ�����ͼ��ʾ������![]() ��ʾ�ĵ�һ����Ӧ������
��ʾ�ĵ�һ����Ӧ������![]() ______ ��
______ ��
���𰸡�![]()
![]()
![]()
![]() D ��
D �� ![]()
��������
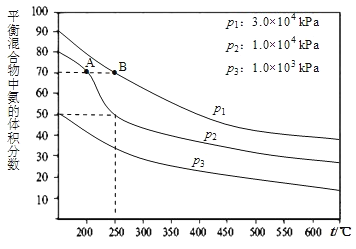
![]() �¶�Խ��ѹǿԽ��Ӧ����Խ��
�¶�Խ��ѹǿԽ��Ӧ����Խ��
![]() ��
��![]() ��
��![]() �£��������������Ϊ
�£��������������Ϊ![]() ����
����

����![]() ���Դ˼���ת���ʣ�
���Դ˼���ת���ʣ�
![]() ��
��![]() ��ˮ��
��ˮ��![]() ������������ϣ����߷�Ӧ����Һ�е�����Ϊ�����ʵ���Ũ�ȵİ�ˮ���Ȼ����Һ����Һ�ʼ��ԣ�˵��һˮ�ϰ�����̶ȴ���笠�����ˮ��̶ȣ�
������������ϣ����߷�Ӧ����Һ�е�����Ϊ�����ʵ���Ũ�ȵİ�ˮ���Ȼ����Һ����Һ�ʼ��ԣ�˵��һˮ�ϰ�����̶ȴ���笠�����ˮ��̶ȣ�
![]() ��ͼʾ��֪��������Ӧ����ɵ���ЧӦ��һ����ɵ���ЧӦ����ͬ�ģ�
��ͼʾ��֪��������Ӧ����ɵ���ЧӦ��һ����ɵ���ЧӦ����ͬ�ģ�
![]() �÷�Ӧ�����������С�ķ��ȷ�Ӧ�����ܼӿ췴Ӧ���ʡ��������ԭ�������ʵĴ�ʩ������ѹǿ��
�÷�Ӧ�����������С�ķ��ȷ�Ӧ�����ܼӿ췴Ӧ���ʡ��������ԭ�������ʵĴ�ʩ������ѹǿ��
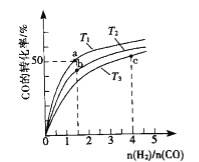
![]() ��֪�ܷ�Ӧ�Ŀ���������һ�����������ͼ��仯���ƣ�ͼ����ﷴӦ���жϣ���Ӧ�����������ݵ�һ���͵ڶ�����Ӧ������б�ʱȽϴ�С��
��֪�ܷ�Ӧ�Ŀ���������һ�����������ͼ��仯���ƣ�ͼ����ﷴӦ���жϣ���Ӧ�����������ݵ�һ���͵ڶ�����Ӧ������б�ʱȽϴ�С��
![]() ����ͼ�����10����ʱ������̼���������ʵ�������ϻ�ѧ��Ӧ���ʸ������õ���
����ͼ�����10����ʱ������̼���������ʵ�������ϻ�ѧ��Ӧ���ʸ������õ���
![]() �¶�Խ��ѹǿԽ��Ӧ����Խ����ͼ��֪��B��Ӧ���¶ȡ�ѹǿ����Ӧ���ʴʴ�Ϊ��
�¶�Խ��ѹǿԽ��Ӧ����Խ����ͼ��֪��B��Ӧ���¶ȡ�ѹǿ����Ӧ���ʴʴ�Ϊ��![]() ��
��
![]() ��
��![]() ��
��![]() �£��������������Ϊ
�£��������������Ϊ![]() ����
���� 
![]() ��
��![]() ��������ת����
��������ת���� ��
��
�ʴ�Ϊ��![]() ��
��
![]() ��
��![]() ��ˮ��
��ˮ��![]() ������������ϣ����߷�Ӧ����Һ�е�����Ϊ�����ʵ���Ũ�ȵİ�ˮ���Ȼ����Һ����Һ�ʼ��ԣ���Һ��
������������ϣ����߷�Ӧ����Һ�е�����Ϊ�����ʵ���Ũ�ȵİ�ˮ���Ȼ����Һ����Һ�ʼ��ԣ���Һ��![]() ��˵��һˮ�ϰ�����̶ȴ���笠�����ˮ��̶ȣ���ϵ���غ��
��˵��һˮ�ϰ�����̶ȴ���笠�����ˮ��̶ȣ���ϵ���غ��![]() ����������Ũ�ȴ�С˳����
����������Ũ�ȴ�С˳����![]() ��
��
�ʴ�Ϊ��![]() ��
��
![]() ��ͼʾ��֪��������Ӧ����ɵ���ЧӦ��һ����ɵ���ЧӦ����ͬ�ģ���������Ӧ��ӿɵ�
��ͼʾ��֪��������Ӧ����ɵ���ЧӦ��һ����ɵ���ЧӦ����ͬ�ģ���������Ӧ��ӿɵ�![]()
![]() ��
��
�ʴ�Ϊ��![]()
![]() ��
��
![]() �÷�Ӧ�����������С�ķ��ȷ�Ӧ�����ܼӿ췴Ӧ���ʡ��������ԭ�������ʵĴ�ʩ������ѹǿ����ѡD��
�÷�Ӧ�����������С�ķ��ȷ�Ӧ�����ܼӿ췴Ӧ���ʡ��������ԭ�������ʵĴ�ʩ������ѹǿ����ѡD��
![]() ��ͼ���֪��15�������ң������Ͷ�����̼��Ӧ���ɰ�������狀��ٱ仯�������ǵ�һ����Ӧ������������������ټ�С���ﵽƽ�⣬�������ǵڶ�����Ӧ��������б�ʲ��ѿ����ڶ�����Ӧ��������������֪�ܷ�Ӧ�Ŀ���������һ��������
��ͼ���֪��15�������ң������Ͷ�����̼��Ӧ���ɰ�������狀��ٱ仯�������ǵ�һ����Ӧ������������������ټ�С���ﵽƽ�⣬�������ǵڶ�����Ӧ��������б�ʲ��ѿ����ڶ�����Ӧ��������������֪�ܷ�Ӧ�Ŀ���������һ��������
�ʴ�Ϊ������
![]() ����ͼ�������������̼�ٽ��е�10minʱ���ʵ���Ϊ
����ͼ�������������̼�ٽ��е�10minʱ���ʵ���Ϊ![]() �����Դ�ʱ�ķ�Ӧ����
�����Դ�ʱ�ķ�Ӧ����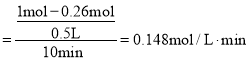 ��
��
�ʴ�Ϊ��![]() ��
��

 ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�
ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д� ���������ν�ϵ�д�
���������ν�ϵ�д�����Ŀ������ʵ�������Ӧ����������ʵ����
ѡ�� | ʵ����� | ���� |
A | ��ʢ�� | ��Һ��Ϊ��ɫ���μ�KSCN����Һ��Ѫ��ɫ |
B | ��ʢ�� | ��Һ����ɫ�����ú�۲쵽��Һ�зֲ����� |
C | �� | �Ȳ�����ɫ�������������ʧ |
D | ��ʢ�� | �д̼�����ζ�����������Һ����� |
A.AB.BC.CD.D