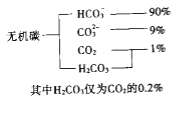
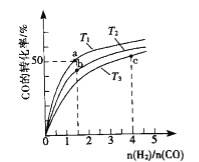
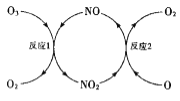
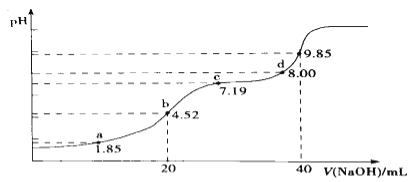
题目内容
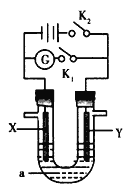
【题目】用碱性丙烷燃料电池电解苦卤水![]() 含
含![]() 、
、![]() 、
、![]() 、
、![]() 的装置如图所示
的装置如图所示![]() 、b为石墨电极
、b为石墨电极![]() ,下列说法正确的是( )
,下列说法正确的是( )
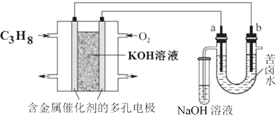
A.电池工作时,负极反应式为:![]()
B.电解时,a电极周围首先放电的是![]() 而不是
而不是![]() ,说明当其他条件相同时后者的还原性强于前者
,说明当其他条件相同时后者的还原性强于前者
C.电解时,电子流动的路径是:负极![]() 外电路
外电路![]() 阴极
阴极![]() 溶液
溶液![]() 阳极
阳极![]() 正极
正极
D.忽略能量损耗,当电池中消耗16gO2时,a极周围会产生0.71gCl2
【答案】A
【解析】
A. 左边能自发的进行氧化还原反应,为原电池,氧气得电子发生还原反应,则通入氧气的电极为正极,丙烷为负极,右边是电解质,a为阳极,b为阴极,原电池工作时,丙烷燃料电池,以氢氧化钾为电解质,电池工作时,负极反应式为:![]() ,故A正确;
,故A正确;
B.还原性强的离子在阳极先放电,电解时,a电极周围首先放电的是![]() 而不是
而不是![]() ,所以还原性:
,所以还原性:![]() ,故B错误;
,故B错误;
C.电子在导线中移动,不能在溶液中移动,故C错误;
D. 若苦卤水只有氯离子,根据转移电子相等可知,当电池中消耗![]() 氧气时,理论上阳极上可以产生
氧气时,理论上阳极上可以产生![]() 氯气,但溶液中有溴离子,溴离子首先发生放电,然后在到氯离子放电,所以氯气的量应该小于
氯气,但溶液中有溴离子,溴离子首先发生放电,然后在到氯离子放电,所以氯气的量应该小于![]() ,故D错误。
,故D错误。
故选A。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
【题目】表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是( )
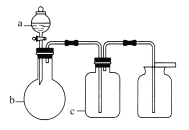
选项 | 气体 | a | b | c |
A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
B | SO2 | 70%的浓H2SO4 | Na2SO3固体 | 98%的浓H2SO4 |
C | NO | 稀HNO3 | 铜屑 | H2O |
D | NO2 | 浓HNO3 | 铜屑 | NaOH溶液 |
A.AB.BC.CD.D