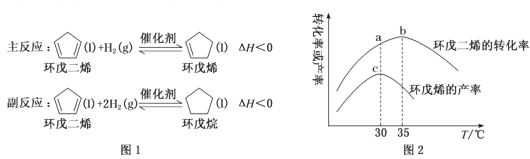
题目内容
【题目】下列有关金属的工业制法中正确的是( )
A.炼铝:用电解氯化铝溶液的方法获得单质铝
B.制钛:用金属钠置换熔融四氯化钛(TiCl4)中的钛
C.制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
D.炼铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中铁的氧化物
【答案】BD
【解析】
A、氯化铝是分子晶体,熔融的氯化铝中不含自由移动的离子;
B、Na是活泼金属,具有强还原性;
C、工业制钠是电解熔融NaCl来制取;
D、炼铁时的主要原理涉及CO与氧化铁的反应。
A、工业上常用惰性电极电解熔融的氧化铝来制取铝,化学方程式为2Al2O3![]() 4Al+3O2↑,故A错误;
4Al+3O2↑,故A错误;
B、Na是活泼金属,具有强还原性,利用钠的强还原性,可用金属钠置换熔融四氯化钛(TiCl4)中的钛,故B正确;
C、工业制钠是电解熔融NaCl:2NaCl![]() 2Na+Cl2↑,而电解纯净的NaCl溶液:2NaCl+2H2O
2Na+Cl2↑,而电解纯净的NaCl溶液:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,得不到钠,故C错误;
2NaOH+H2↑+Cl2↑,得不到钠,故C错误;
D、炼铁时的主要原理涉及CO与氧化铁的反应,CO在高温下还原铁矿石中铁的氧化物,可生成铁,故D正确;
答案选BD。

【题目】实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种。下列根据实验事实得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 取一定量固体溶解,向溶液中通入足量的CO,观察到有晶体析出 | 原固体中一定含Na2CO3 |
B | 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成 | 原固体中一定含有Na2CO3 |
C | 取一定量固体,溶解,向溶液中滴加适量AgNO3 溶液,观察有白色沉淀生成 | 原固体中一定含有NaCl |
D | 称取3.80g固体,加热至恒重,质量减少了0.620g。用足量稀盐酸溶解残留固体,充分反应后,收集到有0.88g气体 | 原固体中三种物质都有 |
A.AB.BC.CD.D