题目内容
14.某物质的结构简式如图,关于该物质的下列说法中正确的是( )
| A. | 该化合物的化学式为C10H11O2 | |
| B. | 分子中所有的碳原子不可能处于同一平面上 | |
| C. | 它的部分同分异构体能发生水解反应时则不能发生消去反应 | |
| D. | 该化合物能与新制的Cu(OH)2溶液发生反应生成砖红色沉淀且苯环上的一氯代物只有一种的同分异构体有4 |
分析 有机物含有碳碳双键,可发生加成、加聚和氧化反应,含有羧基,具有酸性,可发生中和、酯化反应,结合乙烯、苯的结构特点解答该题.
解答 解:A.由结构简式可知有机物分子式为C10H10O2,故A错误;
B.苯环、碳碳双键具有平面形结构,则所有的碳原子可能处于同一平面上,故B错误;
C.能发生水解反应,则含有酯基,此时不含羟基,则不能发生消去反应,故C正确;
D.该化合物能与新制的Cu(OH)2溶液发生反应生成砖红色沉淀且苯环上的一氯代物只有一种,说明分子中应含有2个醛基,且含有两个甲基,可能的结构有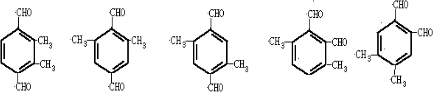 等,故D错误.
等,故D错误.
故选C.
点评 本题考查有机物的结构和性质,为高频考点和常见题型,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质,易错点为D,注意同分异构体的判断,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列有关环境、健康、发展的叙述中,不正确的是( )
| A. | 可吸入颗粒(例如硅酸盐粉尘)形成气溶胶,对人类健康危害极大 | |
| B. | 开发利用绿色能源(例如太阳能)替代化石燃料是人类可持续发展的必由之路 | |
| C. | 装修材料中的苯主要来自胶、漆等,是强致癌物 | |
| D. | 氟氯烃含量是空气质量报告的主要项目之一 |
2.有A、B、C、D四种短周期元素,其简单离子A+、B2+、C-、D2-的电子层结构相同.则下列比较中正确的是( )
| A. | 原子序数:A>B>C>D | B. | 离子半径:A+>B2+>C->D2- | ||
| C. | 氢化物稳定性:H2D>HC | D. | 金属性:A>B |
9.有A、B、C、D四种金属,将A与B用导线连接起来,浸入稀硫酸溶液中,B为正极,将A、D分别投入等浓度盐酸中,D比A反应剧烈,将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出,据此判断它们的活动性由强到弱的顺序是( )
| A. | DABC | B. | DCAB | C. | BADC | D. | ABCD |
19.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O+2AgCl下列“水”电池在海水中放电时的有关说法正确的是( )
| A. | AgCl是还原产物 | |
| B. | 正极反应式:Ag+Cl--e-=AgCl | |
| C. | 每生成1molNa2Mn5O10转移2 mol电子 | |
| D. | Na+不断向“水”电池的负极移动 |
6.化学实验有助于理解化学知识,形成化学观念.下列实验操作正确的是( )

| A. | ①称量药品 | B. | ②过滤 | C. | ③分离乙醇和水 | D. | ④收集氯气 |
3. 某学生欲通过实验方法验证Fe2+的性质.
某学生欲通过实验方法验证Fe2+的性质.
(1)该同学在实验前,依据Fe2+的还原性,填写了下表.
依据表中操作,该同学进行实验,观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.为了进一步探究溶液变为深棕色的原因,该同学进行如下实验.
(2)向原新制FeSO4溶液中反应后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)该同学通过查阅资料,认为溶液的红棕色可能是NO2或NO与溶液中Fe 2+或Fe 3+发生反应而得到的,为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
Ⅰ.打开活塞a,关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化.
Ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应.
Ⅲ.为与Ⅰ中实验进行对照,更换丙,丁后,使甲中反应继续,观察到的现象与步骤Ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤Ⅱ的目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由Fe2+与NO或NO2作用得到;
(4)该同学重新进行(Ⅰ)中实验,观察到了预期现象,其实验操作是向盛有浓硝酸的试管中滴入数滴新制的FeSO4溶液,震荡.
 某学生欲通过实验方法验证Fe2+的性质.
某学生欲通过实验方法验证Fe2+的性质.(1)该同学在实验前,依据Fe2+的还原性,填写了下表.
| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+=Fe3++NO2+H2O |
(2)向原新制FeSO4溶液中反应后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)该同学通过查阅资料,认为溶液的红棕色可能是NO2或NO与溶液中Fe 2+或Fe 3+发生反应而得到的,为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
Ⅰ.打开活塞a,关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化.
Ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应.
Ⅲ.为与Ⅰ中实验进行对照,更换丙,丁后,使甲中反应继续,观察到的现象与步骤Ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤Ⅱ的目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由Fe2+与NO或NO2作用得到;
(4)该同学重新进行(Ⅰ)中实验,观察到了预期现象,其实验操作是向盛有浓硝酸的试管中滴入数滴新制的FeSO4溶液,震荡.
1.某恒温密闭容器中,可逆反应A(s)?B+C(g)△H=-a KJ/mol 达到平衡.缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等.以下分析正确的是( )
| A. | 产物B的状态只能为固态或液态 | |
| B. | 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 | |
| C. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量a KJ | |
| D. | 衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1 |
 (直接标在答题卡的相应方程式上).
(直接标在答题卡的相应方程式上).