题目内容
硫酸用途十分广泛,工业上合成硫酸时,将SO2转化为催化氧化是一个关键步骤。请回答下列问题:
(1)该反应在恒温恒容密闭容器中进行,判断其达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)某温度下,2SO2(g)+O2(g) 2SO3(g) △H=-196 kJ?mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol?L-1?min-1,放出的热量为 kJ。
2SO3(g) △H=-196 kJ?mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol?L-1?min-1,放出的热量为 kJ。
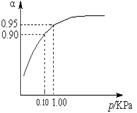
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。试分析工业生产中采用常压的原因是 。
(4)将一定量的SO2和0.7 molO2放入一定体积的密闭容器中,在550℃和催化剂作用下发生反应。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。则该反应达到平衡时SO2的转化率是多少?(要写出计算过程,计算结果保留一位小数。)
(1)该反应在恒温恒容密闭容器中进行,判断其达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)某温度下,2SO2(g)+O2(g)
 2SO3(g) △H=-196 kJ?mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol?L-1?min-1,放出的热量为 kJ。
2SO3(g) △H=-196 kJ?mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol?L-1?min-1,放出的热量为 kJ。 (3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。试分析工业生产中采用常压的原因是 。

(4)将一定量的SO2和0.7 molO2放入一定体积的密闭容器中,在550℃和催化剂作用下发生反应。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。则该反应达到平衡时SO2的转化率是多少?(要写出计算过程,计算结果保留一位小数。)
(1)bc
(2)0.036 17.64
(3)在常压下该反应转化率已很高,若再加压,对设备要求高,同时要消耗大量的能源,不经济。
(4)94.7%
试题分析:(1)“变量不变达平衡”,a。反应物和生成物的浓度不变时达平衡,而不是相等,错误;b。SO2百分含量是变量,不变时达到平衡,正确;c.反应是在恒容的容器中进行,反应前后气体的物质的量会发生变化,故容器中气体的压强是变量,正确; d.SO3的生成速率与SO2的消耗速率是同一个方向,一定相等,错误;e.容器体积固定,气体的质量固定,气体的密度是定量,错误;
(2)v(O2)=v (SO3)/2=0.18÷5÷0.5÷2=0.036mol?L-1?min-1,放出的热量为196÷2×0.18=17.64kJ;
(3)在常压下该反应转化率已很高,若再加压,对设备要求高,同时要消耗大量的能源,不经济。
(4)通过过量NaOH溶液,被吸收的为SO2和SO3,物质的量为21.28÷22.4=0.95mol;剩余氧气的量为5.6÷22.4=0.25mol,反应的氧气为0.7-0.25=0.45mol,生成SO3的量为0.45×2=0.9mol;故剩余SO2的量为0.95-0.9=0.05mol,其始量为0.95+0.05=1.00mol,转化率为0.95÷1.00=0.95

练习册系列答案
相关题目


 CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1),下列说法正确的是
CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1),下列说法正确的是 mol·L-1·min-1
mol·L-1·min-1 CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中t2>t1): Ag(s)+Fe3+ ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是( )
Ag(s)+Fe3+ ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是( ) AB来说,常温下按以下情况进行反应:
AB来说,常温下按以下情况进行反应: