题目内容
9.下列每组中两种物质反应时,无论哪种过量都可用同一离子方程式表示的是( )| A. | FeBr2溶液与Cl2 | B. | Ca(HCO3)2溶液与KOH溶液 | ||
| C. | NaHCO3溶液与Al2(SO4)3溶液 | D. | NaHSO4溶液与Ba(OH)2溶液 |
分析 A.亚铁离子的还原性大于溴离子,若氯气不足,亚铁离子优先反应,如果氯气过量,则亚铁离子和溴离子都完全被氧化,氯气的量不同,离子方程式不同;
B.碳酸氢钙过量时,反应生成碳酸钙、碳酸氢钾和水,氢氧化钾过量时,反应生成碳酸钙沉淀、碳酸钾和水;
C.碳酸氢根离子与铝离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,与反应物过量情况无关;
D.如果NaHSO4少量参加反应的钡离子和氢氧根离子之比为1:1,如果Ba(OH)2少量参加反应的钡离子和氢氧根离子之比为1:2.
解答 解:A.FeBr2溶液与Cl2:氯气过量时,亚铁离子和溴离子都被氯气氧化,若氯气不足,只有亚铁离子被氯气氧化,所以氯气的过量与不足时,离子方程式不同,故A错误;
B.Ca(HCO3)2溶液与KOH溶液:若碳酸氢钙过量,反应生成的是碳酸钙沉淀、碳酸氢钾和水,若氢氧化钾过量,反应生成碳酸钙沉淀、碳酸钾和水,二者过量情况不同,反应的离子方程式不同,故B错误;
C.NaHCO3和Al2(SO4)3两种浓溶液,无论二者是否过量,都发生相互促进的水解反应生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,故C正确;
D.NaHSO4、Ba(OH)2溶液;如果NaHSO4少量参加反应的钡离子和氢氧根离子之比为1:1,如果Ba(OH)2少量参加反应的钡离子和氢氧根离子之比为1:2,二者的物质的量不同,离子方程式不同,故D错误;
故选C.
点评 本题考查离子反应方程式的书写,为高频考点,题目难度中等,侧重考查反应物过量情况对生成物的影响,明确离子方程式的书写原则为解答关键.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
19.常言“真金不怕火炼”从化学的角度对这句话的理解正确的是( )
| A. | 金在高温下发生了钝化 | B. | 金越炼硬度越大 | ||
| C. | 金的化学性质稳定,不易变质 | D. | 金的硬度大,高温下难于变形 |
20.下列叙述正确的是( )
| A. | 离子晶体中一定含有离子键 | |
| B. | 分子晶体中一定含有共价键 | |
| C. | 氧化钠和过氧化钠中含有的化学键种类相同 | |
| D. | 通常情况下水分子较稳定,是因为水分子间存在氢键 |
17.下列指定反应的离子方程式正确的是( )
| A. | 向铁粉中加入足量稀硝酸:2Fe+6H+═2Fe3++3H2↑ | |
| B. | NO2溶于水:3NO2+H2O═2H++2NO3-+NO | |
| C. | 氢氧化铜与稀硝酸反应:H++OH-═H2O | |
| D. | 向AlCl3溶液中滴加浓氨水至过量:Al3++4OH-═AlO2-+2H2O |
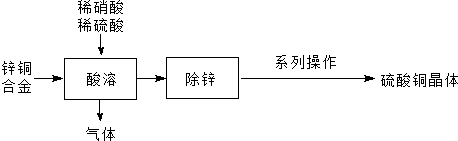
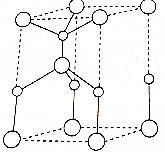 利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,如图为其晶胞结构水土,则每个晶胞中含有B原子的个数为2,该功能陶瓷的化学式为BN.
利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,如图为其晶胞结构水土,则每个晶胞中含有B原子的个数为2,该功能陶瓷的化学式为BN. 已知A、B、C、D是中学化学中常见的四种不同微粒.它们之间存在如图中转化关系:
已知A、B、C、D是中学化学中常见的四种不同微粒.它们之间存在如图中转化关系: