题目内容
【题目】为了预防碘缺乏症,国家规定每千克食盐中应含有40~50 mg碘酸钾。碘酸钾晶体具有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂反应生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等更强的氧化剂氧化为更高价的碘的含氧酸盐。工业生产碘酸钾的流程如图所示。

(1)碘在周期表中的位置为__________________;
(2)碘、氯酸钾、水混合反应时,若两种还原产物所得电子的数目相同,请配平该反应的化学方程式:____I2+____KClO3+____H2O=____KH(IO3)2+____KCl+____Cl2↑;
(3)混合反应后,用稀酸酸化的作用是___________________________,在稀盐酸和稀硝酸中不能选用的酸是_________,理由是__________________________________;
(4)试剂X的化学式为__________,写出用试剂X调pH的化学方程式__________________;
(5)如果省略“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应混合物的pH,对生产碘酸钾有什么影响?________________________________________。
【答案】
(1)第五周期 第ⅦA族
(2)6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑
(3)促进氯气从反应混合物中逸出 稀盐酸 盐酸能还原已生成的碘酸氢钾
(4)KOH KH(IO3)2+KOH=2KIO3+H2O
(5)反应产生的氯气能与氢氧化钾溶液反应生成KClO,KClO能将KIO3氧化成KIO4,从而不能得到碘酸钾
【解析】
试题分析:(1)碘的原子序数是127,在周期表中的位置为第五周期第第ⅦA族;
(2)根据方程式可知反应中I的化合价从0价升高到+5价,失去5个电子。氯酸钾中Cl元素化合价从+5价降低到0价和—1价,两种还原产物所得电子的数目相同,所以根据电子得失守恒可知配平后的方程式为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;
(3)混合反应后,用稀酸酸化,溶液酸性增强,因此其作用是促进氯气从反应混合物中逸出;由于盐酸能还原已生成的碘酸氢钾,所以不能选择盐酸;
(4)晶体①为KH(IO3)2,把晶体从溶液中过滤出来,洗涤干净,然后用水溶解得到KH(IO3)2的溶液,要把酸式盐变为正盐KIO3,就要加碱来调节溶液的pH值。为了不引入新的杂质,所以要用KOH。该反应的方程式为KH(IO3)2+KOH=2KIO3+H2O;
(5)反应I2+KClO3+H2O→KH(IO3)2+KCl+Cl2↑产生的氯气跟KOH反应生成KClO,KClO能将KIO3氧化成KIO4,从而不能得到碘酸钾。

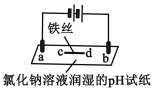
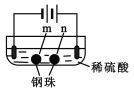
【题目】用石墨电极完成下列电解实验。
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;…… |
下列对实验现象的解释或推测不合理的是
A.a、d处:2H2O+2e-=H2↑+2OH-
B.b处:2Cl--2e-=Cl2↑
C.c处发生了反应:Fe-2e-=Fe2+
D.根据实验一的原理,实验二中m处能析出铜