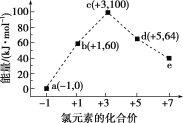
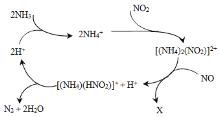
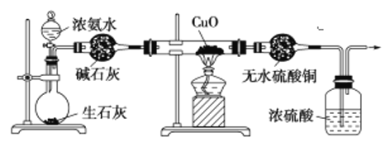
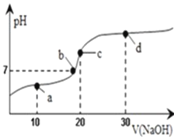
题目内容
【题目】多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。
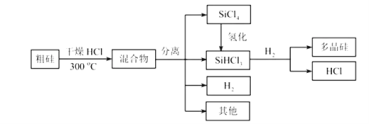
回答下列问题:
(I)硅粉与HCl在300℃时反应生成1mol SiHCl3气体和![]() ,放出225kJ热量,该反应的热化学方程式为________________________。
,放出225kJ热量,该反应的热化学方程式为________________________。![]() 的电子式为__________________。
的电子式为__________________。
(II)将![]() 氢化为
氢化为![]() 有三种方法,对应的反应依次为:
有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g)![]() SiHCl3(g)+HCl(g)△H1>0
SiHCl3(g)+HCl(g)△H1>0
②3SiCl4(g)+2H2(g)+Si(s)![]() 4SiHCl3(g) △H2>0
4SiHCl3(g) △H2>0
③3SiCl4(g)+H2(g)+Si(s)+HCl(g)![]() 3SiHCl3△H3
3SiHCl3△H3
反应③的![]() ______(用△H1,△H2表示)。温度升高,反应③的平衡常数K______(填“增大”、“减小”或“不变”)。
______(用△H1,△H2表示)。温度升高,反应③的平衡常数K______(填“增大”、“减小”或“不变”)。
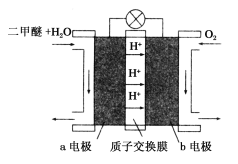
(III)如图为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图.b电极是________极。请写出负极的电极反应方程式:__________________
【答案】Si(s)+3HCl(g)![]() SiHCl(g)+H2(g)△H=-225KJ/mol
SiHCl(g)+H2(g)△H=-225KJ/mol 
![]() 减小 正 C2H6O-12e-+3H2O=2CO2+12H+
减小 正 C2H6O-12e-+3H2O=2CO2+12H+
【解析】
(I)硅粉与HCl在300℃时反应生成1molSiHCl3气体和H2,放出225kJ热量,根据反应热及反应物状态、反应条件书写该反应的热化学方程式为Si(s)+3HCl(g)![]() SiHCl(g)+H2(g)△H=-225KJ/mol,SiHCl3中存在1个Si-H键、3个Si-Cl键,其电子式为
SiHCl(g)+H2(g)△H=-225KJ/mol,SiHCl3中存在1个Si-H键、3个Si-Cl键,其电子式为 ;
;
(Ⅱ)①SiCl4(g)+H2(g)![]() SiHCl3(g)+HCl(g)△H1>0②3SiCl4(g)+2H2(g)+Si(s)
SiHCl3(g)+HCl(g)△H1>0②3SiCl4(g)+2H2(g)+Si(s)![]() 4SiHCl3(g) △H2>0将方程式②-①得③3SiCl4(g)+H2(g)+Si(s)+HCl(g)
4SiHCl3(g) △H2>0将方程式②-①得③3SiCl4(g)+H2(g)+Si(s)+HCl(g)![]() 3SiHCl3△H3=H2-H1<0,升高温度平衡向吸热方向移动,该反应的正反应是放热反应,升高温度平衡逆向移动,所以升高温度反应③的平衡常数K减小;
3SiHCl3△H3=H2-H1<0,升高温度平衡向吸热方向移动,该反应的正反应是放热反应,升高温度平衡逆向移动,所以升高温度反应③的平衡常数K减小;
(Ⅲ)根据电池示意图,该电池的总反应为CH3OCH3+3O2=2CO2+3H2O,二甲醚为负极失电子,电极方程式为CH3OCH3-12e-+3H2O=2CO2+12H+,氧气为正极得电子,电极方程式为O2+4e-+4H+=2H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案