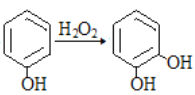
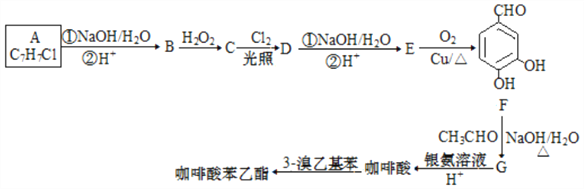
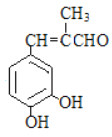
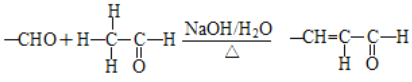题目内容
【题目】碳酸镧咀嚼片是一种不含钙和铝的磷酸盐结合剂,用于慢性肾衰患者高磷血症的治疗。碳酸镧可由 LaCl3 为原料来制备,整个反应在较低的pH条件下进行,避免生成碱式碳酸镧[La(OH)CO3]。
(1)化学兴趣小组利用下列装置在实验室中用碳酸氢铵制备碳酸镧。

①仪器 X 的名称为________;检验装置甲气密性良好的方法是___________。
②实验中 K1、 K2 打开的先后顺序为________;为保证碳酸镧的纯度,实验过程中需要注意的问题有____________。
(2)碳酸钠或碳酸氢钠与氯化镧反应均可生成碳酸镧。
①为了高磷血症患者的安全,通常选用碳酸氢钠溶液,过程中会发生两个平行反应,其离子方程式为_______和____________。
②选择碳酸氢钠溶液制备碳酸镧的优点是___________(任写一条)。
③T℃时,碳酸镧的溶解度为1.0×10-7 mol·L-1, HCO3-的电离平衡常数为 6.0×10-11。请计算反应 2LaCl3+3NaHCO3![]() La2(CO3)3↓+3NaCl+3HCl 的平衡常数 K=_________。
La2(CO3)3↓+3NaCl+3HCl 的平衡常数 K=_________。
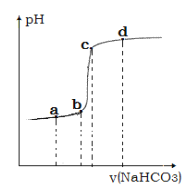
④利用手持技术测定溶液的 pH 从而监控反应过程,得到如图曲线。请说明 bc 段变化的原因__________。
(3)碳酸镧(式量为 458)质量分数的测定:准确称取15.0g产品试样,溶于10.0mL 稀盐酸中,加入 10mLNH3-NH4Cl 缓冲溶液,加入 0.2g 紫脲酸铵混合指示剂,用 0.5 mol·L-1EDTA(Na2H2Y)标准溶液滴定至呈蓝紫色(La3++H2Y2-= LaY-+2H+),消耗 EDTA 溶液 60.00mL。则产品中碳酸镧的质量分数 w=________。
【答案】 球形干燥管 关闭活塞 K1,向球形漏斗中加水至漏斗内外形成液面差,一段时间后,液面差保持不变,说明气密性良好 先打开 K2 再打开 K1 控制氨气(或CO2)通入量 2La2+ +3HCO3- = La 2(CO3)3+3H+ H++HCO3- =CO2+H2O 碳酸氢钠碱性相对较弱,可防止生成碱式碳酸镧[La(OH)CO3] 200 La3+完全沉淀, 再滴入碳酸氢钠,水解使溶液的碱性增强,pH发生突跃 91.6%
【解析】(1)①仪器 X 的名称为球形干燥管;检验装置甲气密性良好的方法是关闭活塞 K1,向球形漏斗中加水至漏斗内外形成液面差,一段时间后,液面差保持不变,说明气密性良好;②氨气是极易溶于水的气体,先通氨气,在碱性条件下再通入二氧化碳,溶解的量较大,故实验中先打开 K2 再打开 K1;为保证碳酸镧的纯度,实验过程中需要控制氨气(或CO2)通入量;(2)①碳酸氢钠分别与和La2+、H+反应,过程中会发生两个平行反应的离子方程式为2La2+ +3HCO3- = La 2(CO3)3+3H+和H++HCO3- =CO2+H2O;②选择碳酸氢钠溶液制备碳酸镧的优点是碳酸氢钠碱性相对较弱,可防止生成碱式碳酸镧[La(OH)CO3];③2LaCl3+3NaHCO3![]() La2(CO3)3↓+3NaCl+3HCl 的离子反应方程式为2La2+ +3HCO3- = La 2(CO3)3↓+3H+,T℃时,碳酸镧的溶解度为1.0×10-7 mol·L-1,则饱和溶液中c(La2+)=2c[La 2(CO3)3]= 2.0×10-7 mol·L-1,c(CO32-)=3c[La 2(CO3)3]= 3.0×10-7 mol·L-1,Ksp[La 2(CO3)3]= c2(La2+) c3(CO32-)=(2.0×10-7 mol·L-1)2×(3.0×10-7 mol·L-1)3=1.08×10-33,HCO3-的电离平衡常数为 6.0×10-11,则反应的平衡常数 K=
La2(CO3)3↓+3NaCl+3HCl 的离子反应方程式为2La2+ +3HCO3- = La 2(CO3)3↓+3H+,T℃时,碳酸镧的溶解度为1.0×10-7 mol·L-1,则饱和溶液中c(La2+)=2c[La 2(CO3)3]= 2.0×10-7 mol·L-1,c(CO32-)=3c[La 2(CO3)3]= 3.0×10-7 mol·L-1,Ksp[La 2(CO3)3]= c2(La2+) c3(CO32-)=(2.0×10-7 mol·L-1)2×(3.0×10-7 mol·L-1)3=1.08×10-33,HCO3-的电离平衡常数为 6.0×10-11,则反应的平衡常数 K=![]() ;④利用手持技术测定溶液的 pH 从而监控反应过程,La3+完全沉淀, 再滴入碳酸氢钠,水解使溶液的碱性增强,pH发生突跃,bc 段变化如图曲线;(3)滴定时消耗 EDTA 溶液的物质的量为60.00mL×10-3L/mL×0.5 mol/L=0.03mol,根据反应La3++H2Y2-= LaY-+2H+可知,产品中碳酸镧的质量分数 w=
;④利用手持技术测定溶液的 pH 从而监控反应过程,La3+完全沉淀, 再滴入碳酸氢钠,水解使溶液的碱性增强,pH发生突跃,bc 段变化如图曲线;(3)滴定时消耗 EDTA 溶液的物质的量为60.00mL×10-3L/mL×0.5 mol/L=0.03mol,根据反应La3++H2Y2-= LaY-+2H+可知,产品中碳酸镧的质量分数 w=![]() 。
。

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案【题目】锰主要用于钢铁工业生产锰合金钢,锰的化合物有+2、+4、+6、+7 等多种变价,以菱锰矿(主要成分为 MnCO3,还含有少量铁、镍、 钴等碳酸盐杂质)为原料经过一系列反应生产金属锰和高锰酸钾的工艺流程如下:

已知 25 ℃时,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)酸溶浸过程中,硫酸需稍过量,除保证反应充分进行外,其他作用还有_________(任写一条)。
(2)除杂1过程加入MnO2后,发生氧化还原反应的离子方程式为_________;滤渣2 的主要成分是____________________________。
(3)为加快过滤速度,选择如图抽滤装置完成。下列有关操作和说法正确的是______。

a. 抽滤的本质是加压过滤
b. 抽滤成功的关键在于合理控制水的流速
c. 微粒直径大于滤纸孔径的物质进入吸滤瓶中
(4)电解1过程阳极电极反应式为____________。
(5)H2O2 是一种常用的绿色氧化剂,在平炉反应中不用 H2O2的原因是__________。
(6)“CO2歧化法” 制备 KMnO4是传统工艺,写出该歧化反应的化学方程式_____________。
【题目】将下图中所列仪器组装为一套实验室蒸馏石油的装置,并进行蒸馏,得到汽油和煤油。
(三) | (一) | (五) |
|
|
|
(二) | (六) | (四) |
|
|
|
(1)图中A、B、C三种仪器的名称是_________________________________。
(2)将以下(一)~(六)中的仪器,用字母a、b、c……表示连接顺序:e接( );( )接( );( )接( );( )接( );( )接( )。_____________
(3)A仪器中c口用于________,d口用于________。
(4)蒸馏时,温度计水银球应处在________位置。
(5)在B中注入原油后,加几片碎瓷片的目的是____________________。
(6)在B加热,收集到沸点为60℃~150℃间的馏分是________,收集到沸点为150℃~300℃间的馏分是________。