题目内容
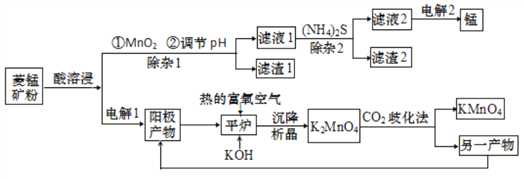
【题目】锰主要用于钢铁工业生产锰合金钢,锰的化合物有+2、+4、+6、+7 等多种变价,以菱锰矿(主要成分为 MnCO3,还含有少量铁、镍、 钴等碳酸盐杂质)为原料经过一系列反应生产金属锰和高锰酸钾的工艺流程如下:

已知 25 ℃时,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)酸溶浸过程中,硫酸需稍过量,除保证反应充分进行外,其他作用还有_________(任写一条)。
(2)除杂1过程加入MnO2后,发生氧化还原反应的离子方程式为_________;滤渣2 的主要成分是____________________________。
(3)为加快过滤速度,选择如图抽滤装置完成。下列有关操作和说法正确的是______。

a. 抽滤的本质是加压过滤
b. 抽滤成功的关键在于合理控制水的流速
c. 微粒直径大于滤纸孔径的物质进入吸滤瓶中
(4)电解1过程阳极电极反应式为____________。
(5)H2O2 是一种常用的绿色氧化剂,在平炉反应中不用 H2O2的原因是__________。
(6)“CO2歧化法” 制备 KMnO4是传统工艺,写出该歧化反应的化学方程式_____________。
【答案】 提供除杂 1 时所需要的酸性环境、抑制 Mn2+的水解 MnO2+2Fe2++4H+===Mn2++2Fe3++2H2O CoS 和 NiS b Mn2++2H2O -2e- = MnO2+4H+ 锰的化合物可催化 H2O2 的分解,使消耗的 H2O2 增多 3K2MnO4 +4CO2+2H2O=2KMnO4+MnO2+4KHCO3或3K2MnO4 +2CO2=2KMnO4+MnO2+2K2CO3
【解析】(1)酸溶浸过程中,硫酸需稍过量,除保证反应充分进行外,其他作用还有提供除杂 1 时所需要的酸性环境、抑制 Mn2+的水解;(2)除杂1过程加入MnO2后,将Fe2+氧化为Fe3+,以便于通过调节pH使其转化为沉淀而除去,发生氧化还原反应的离子方程式为MnO2+2Fe2++4H+===Mn2++2Fe3++2H2O;滤渣1为氢氧化铁,再加入硫化铵将钴镍转化为难溶的硫化物,故滤渣2 的主要成分是CoS 和 NiS;(3)a. 抽滤的本质是减压过滤,选项a错误;b. 抽滤成功的关键在于合理控制水的流速,选项b正确;c. 微粒直径小于滤纸孔径的物质进入吸滤瓶中,选项c错误。答案选b;(4)电解1过程阳极Mn2+失电子产生MnO2,电极反应式为Mn2++2H2O -2e- = MnO2+4H+;(5)H2O2 是一种常用的绿色氧化剂,在平炉反应中不用 H2O2的原因是锰的化合物可催化 H2O2 的分解,使消耗的 H2O2 增多;(6)“CO2歧化法” 制备 KMnO4是传统工艺,该歧化反应锰的化合价由+6价变为+7价和+4价,发生的化学方程式为3K2MnO4 +4CO2+2H2O=2KMnO4+MnO2+4KHCO3或3K2MnO4 +2CO2=2KMnO4+MnO2+2K2CO3。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】锰主要用于钢铁工业生产锰合金钢,锰的化合物有+2、+4、+6、+7 等多种变价,以菱锰矿(主要成分为 MnCO3,还含有少量铁、镍、 钴等碳酸盐杂质)为原料经过一系列反应生产金属锰和高锰酸钾的工艺流程如下:
已知 25 ℃时,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)酸溶浸过程中,硫酸需稍过量,除保证反应充分进行外,其他作用还有_________(任写一条)。
(2)除杂1过程加入MnO2后,发生氧化还原反应的离子方程式为_________;滤渣2 的主要成分是____________________________。
(3)为加快过滤速度,选择如图抽滤装置完成。下列有关操作和说法正确的是______。
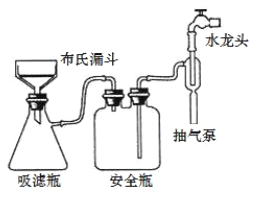
a. 抽滤的本质是加压过滤
b. 抽滤成功的关键在于合理控制水的流速
c. 微粒直径大于滤纸孔径的物质进入吸滤瓶中
(4)电解1过程阳极电极反应式为____________。
(5)H2O2 是一种常用的绿色氧化剂,在平炉反应中不用 H2O2的原因是__________。
(6)“CO2歧化法” 制备 KMnO4是传统工艺,写出该歧化反应的化学方程式_____________。