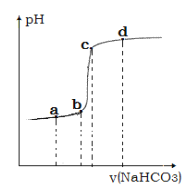
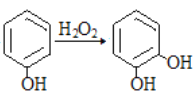
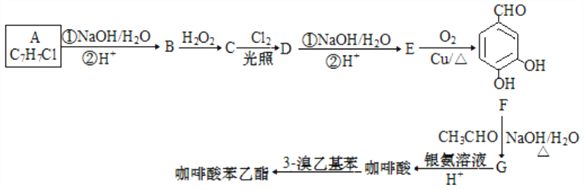
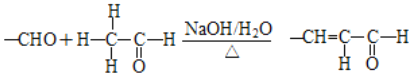题目内容
【题目】下列关于元素周期表的说法正确的是
A.能生成碱的金属元素都在ⅠA族
B.原子序数为114的元素位于元素周期表的第七周期ⅣA族
C.稀有气体元素原子的最外层电子数均为8
D.第ⅥA族元素的最高正价与最低负价的代数和为4
【答案】B
【解析】
A. 能生成碱的金属元素有的在ⅠA族、有的在ⅡA,例如镁等,A错误;
B. 原子序数为118的元素位于元素周期表的第七周期零族,则原子序数为114的元素位于元素周期表的第七周期ⅣA族,B正确;
C. 除He外,其余稀有气体元素原子的最外层电子数均为8,C错误;
D. 第ⅥA族元素的最高正价与最低负价的代数和为+4+(-4)=0,D错误;
答案选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】根据编号①~⑩代表的元素在周期表中的位置,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)最高正价为+1价,还能显﹣1价的元素是____(填元素符号);⑦、⑧、⑨三种元素最高价氧化物对应的水化物,碱性由强到弱的顺序排列为________(填化学式).
(2)③的单质在空气中充分燃烧的化学方程式是________________________________.④与⑥形成的稳定化合物的电子式为______________.
(3)①、⑤、⑥三种元素形成的一种常见盐的化学式为________________,其中含有的化学键类型为_________________.
(4)高温灼烧由⑦与⑩形成的化合物时,火焰呈___色.⑤的最高价氧化物水化物的稀溶液与金属铜反应的离子方程式为______________________.