题目内容
【题目】铁及其化合物在生产生活及科研中应用广泛。
(1)聚合硫酸铁的化学式为[![]() ]m,是常用的水处理剂。基态铁原子的核外电子排布式为___________,聚合硫酸铁中铁元素阳离子有_________个未成对电子。
]m,是常用的水处理剂。基态铁原子的核外电子排布式为___________,聚合硫酸铁中铁元素阳离子有_________个未成对电子。
(2)Fe3+、Co3+与N3-、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为_______,1mol [Fe(CN)6]3-离子中含有σ键的数目为__________。
②已知N3-与CS2为等电子体,则N3-的空间构型为_________。
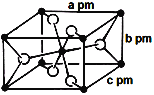
(3)氟化亚铁晶胞属于四方晶系,其长方体结构如图所示,根据图中所示数据计算该晶体密度ρ=_________g·cm-3。(列出计算式即可)(1pm=10-12m)
【答案】 1s22s22p63s23p63d64s2或[Ar] 3d64s2 5 sp 12NA 直线型 ![]()
【解析】(1)铁原子的电子排布式为1s22s22p63s23p63d64s2或[Ar] 3d64s2;根据聚合硫酸铁的化学式知,聚合硫酸铁中铁元素的化合价为+3价,聚合硫酸铁中铁元素阳离子有5个未成对电子;(2)①CN-中C原子价层电子对个数=1+![]() (4+1-1×3)=2,所以采取sp杂化;中含有6
(4+1-1×3)=2,所以采取sp杂化;中含有6![]() 个σ键,1mol [Fe(CN)6]3-离子中含有σ键的数目为12NA;②N3-与CO2是等电子体,具有相同的价电子数,它们具有相似的化学结构,二氧化碳是直线型分子,所以N3-的空间构型是直线型; (4)由题图知,该晶胞中黑球个数为8×
个σ键,1mol [Fe(CN)6]3-离子中含有σ键的数目为12NA;②N3-与CO2是等电子体,具有相同的价电子数,它们具有相似的化学结构,二氧化碳是直线型分子,所以N3-的空间构型是直线型; (4)由题图知,该晶胞中黑球个数为8×![]() +1=2,白球个数为4×
+1=2,白球个数为4×![]() +2=4,则黑球代表Fe原子,白球代表F原子,故该晶体的密度ρ=
+2=4,则黑球代表Fe原子,白球代表F原子,故该晶体的密度ρ=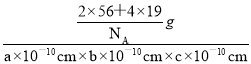 =
=![]() g·cm-3。
g·cm-3。

练习册系列答案
相关题目