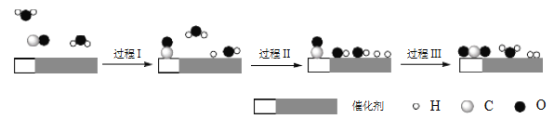
题目内容
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液 pH,金属阳离子浓度的变化如图所示.据图分析,则下列判断错误的是

A. Ksp〔Fe(OH)3〕<Ksp〔Cu(OH)2〕
B. 加适量浓NH3·H2O可使溶液由a 点变到b点
C. c、d两点代表的溶液中c(H+) 与c(OH-)乘积不相等
D. Fe(OH)3在d点代表的溶液过饱和
【答案】C
【解析】
A项,b点pH=1.3,c(OH-)=10-12.7mol/L,有Ksp〔Fe(OH)3〕=c(Fe3+)![]() c3(OH-)=(10-12.7)3c(Fe3+),c点时pH=4.4,c(OH-)=10-9.6mol/L,有Ksp〔Cu(OH)2〕=c(Cu2+)
c3(OH-)=(10-12.7)3c(Fe3+),c点时pH=4.4,c(OH-)=10-9.6mol/L,有Ksp〔Cu(OH)2〕=c(Cu2+)![]() c2(OH-)=(10-9.6)2c(Cu2+),溶液在b、c两点时c(Fe3+)= c(Cu2+),可知Ksp〔Fe(OH)3〕<Ksp〔Cu(OH)2〕,故A项正确;
c2(OH-)=(10-9.6)2c(Cu2+),溶液在b、c两点时c(Fe3+)= c(Cu2+),可知Ksp〔Fe(OH)3〕<Ksp〔Cu(OH)2〕,故A项正确;
B项,溶液由a点变到b点即溶液pH变大,向溶液中加入适量浓NH3·H2O会使溶液pH值变大,因此能使溶液由a点变到b点,故B项正确;
C项,因为温度不变,所以该溶液中c(H+) 与c(OH-)的乘积,即水的离子积常数Kw不变,故C项错误;
D项,d点在Fe(OH)3沉淀溶解平衡曲线上方,因此这时的溶液过饱和,故D项正确。
综上所述,本题正确答案为C。

 阅读快车系列答案
阅读快车系列答案【题目】在一定温度下,将气体0.22 mol X和气体0.16 mol Y充入5 L恒容密闭容器中,发生反应2X(g) + Y(g) ![]() 2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A. 该温度下此反应的平衡常数K = 72.0 L/mol
B. 反应前2 min的平均速率υ(Z) = 4.0×10-3 mol/(L·min)
C. 其他条件不变,降低温度,反应达到新平衡前υ(逆) > υ(正)
D. 其他条件不变,再充入0.1 mo1 X,新平衡时X的转化率将增大
【题目】以下实验方案合理的是( )
实验目的 | 实验设计 | |
A | 鉴别乙醇和二甲醚 | 分别取少量样品用元素分析仪进行测定 |
B | 用高锰酸钾溶液滴定未知浓度的乙二酸溶液 | 用待装液体分别润洗酸式和碱式滴定管再进行操作 |
C | 确定某无色溶液中含有 | 取少量待测液加 |
D | 鉴别 | 分别滴加氨水至过量,观察现象 |
A. AB. BC. CD. D