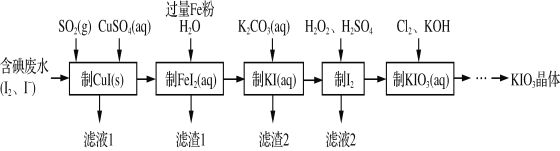
题目内容
【题目】在下列化学反应中,所断裂的共价键中,仅仅断裂δ键的是 ( )
A. N2+3H2  2NH3
2NH3
B. 2C2H2+5O2![]() 2H2O+4CO2
2H2O+4CO2
C. Cl2+H2![]() 2HCl
2HCl
D. C2H4+H2![]() C2H6
C2H6
【答案】C
【解析】
共价单键为σ键;共价双键中含1个σ键和1个π键,共价三键中含1个σ键和2个π键,据此答题。
A.N2分子中存在共价三键,反应时三键中的1个σ键和2个π键均断裂,故A错误;
B.C2H2分子中存在三键,反应时三键中的1个σ键和2个π键均断裂,故B错误;
C.H2、Cl2分子中均为单键,反应时仅仅断裂σ键,故C正确;
D.C2H4分子中存在碳碳双键,C2H6中存在碳碳单键,C2H4与H2发生加成反应时π键发生断裂,故D错误。
故选C。

练习册系列答案
相关题目