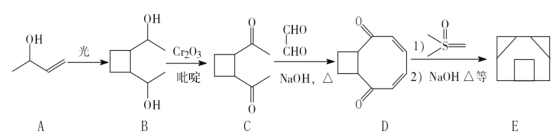
题目内容
【题目】由含碘废水制取碘酸钾的一种工艺如下:
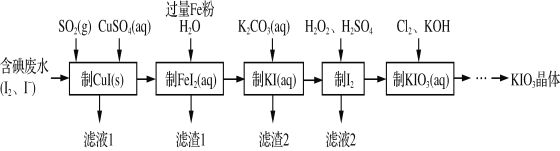
⑴ 写出KIO3在日常生活中的一个重要应用________________________。
⑵ 检验“含碘废水”中是否含有单质I2的常用试剂是________(写试剂名称)。
⑶ 通入SO2的目的是将I2还原为I-,该反应的离子方程式为______________________。
⑷ 工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制________”。
⑸ “制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。
为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I-,起始加入K2CO3必须保持溶液的pH不大于______。
⑹ “制KIO3溶液”反应的离子方程式为__________________。

⑺ KCl、KIO3的溶解度曲线如图所示。流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为_____________________。
【答案】食盐添加剂,补充碘成分,预防碘缺乏病 淀粉溶液 SO2+I2+2H2O=SO42-+2I-+4H+( 或2SO2+I2+2Cu2++4H2O=2CuI↓+2 SO42-+8H+) KI(aq) 6.0 5Cl2+I2+12OH-=2IO3-+10Cl-+6H2O 蒸发浓缩,降温结晶
【解析】
含碘废水制取碘酸钾晶体,由实验流程可知,含碘废水中加入SO2和硫酸铜制备CuI,发生2SO2+I2+2Cu2++4H2O═2CuI↓+2SO42-+8H+,滤液1含硫酸,过滤得到滤渣中加入铁粉、水制备FeI2,过滤得到滤渣1中含有Fe和Cu,滤液中加入碳酸钾制备KI,发生K2CO3+FeI2=FeCO3↓+2KI,滤渣2为FeCO3;酸性条件下KI、过氧化氢发生氧化还原反应生成碘,滤液2含硫酸钾,然后碘、氯气、KOH发生5Cl2+I2+12OH-═2IO3-+10Cl-+6H2O制备碘酸钾,结合溶解度曲线和物质的性质分析解答。
⑴ KIO3是日常生活中食用加碘盐的主要添加剂,可以预防碘缺乏病,故答案为:食盐添加剂,补充碘成分,预防碘缺乏病;
(2)因淀粉遇碘变蓝,因此检验“含碘废水”中是否含有单质I2,常用的试剂是淀粉溶液,故答案为:淀粉溶液;
(3)通入SO2的目的是将I2还原为I-,二氧化硫被氧化生成硫酸,反应的离子方程式为SO2+I2+2H2O═SO42-+2I-+4H+(或2SO2+I2+2Cu2++4H2O═2CuI↓+2SO42-+8H+),故答案为:SO2+I2+2H2O═SO42-+2I-+4H+(或2SO2+I2+2Cu2++4H2O═2CuI↓+2SO42-+8H+);
⑷ 根据工艺流程图,五种物质的制备反应中,只有制备KI溶液的过程中没有元素化合价的变化,不涉及氧化还原反应,故答案为:KI(aq);
(5)Ksp[Fe(OH)2]=9.0×10-15,现测得溶液中c(FeI2)为0.9 molL-1,则c(OH-)=![]() =10-7mol/L,此温度下,Kw=1.0×10-13,c(H+)=
=10-7mol/L,此温度下,Kw=1.0×10-13,c(H+)=![]() =10-6mol/L,pH=-lg10-6=6.0,故答案为:6.0;
=10-6mol/L,pH=-lg10-6=6.0,故答案为:6.0;
(6)“制KIO3溶液”时,氯气和碘单质与氢氧化钾溶液反应生成KIO3和氯化钾,反应的离子方程式为5Cl2+I2+12OH-═2IO3-+10Cl-+6H2O,故答案为:5Cl2+I2+12OH-═2IO3-+10Cl-+6H2O;
(7)由溶解度曲线图可知,KIO3的溶解度小于KCl且KIO3的溶解度随温度升高而增大,由KIO3溶液得到KIO3晶体,可以通过蒸发浓缩、降温结晶的方法得到,故答案为:蒸发浓缩、降温结晶。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案