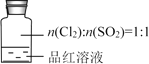��Ŀ����
����Ŀ����ҵ�ϣ��Ӿ��ƺ��ٿ�(FeWO4��MnWO4)����ȡ�����ٵ�һ����������ͼ��ʾ��������ͬʱ��ȡ������Fe2O3��MnCl2��

��֪��I�����̢�~���У��ٵĻ��ϼ۾����䣻
����������������ˮ��
��25��ʱ��Ksp[Fe(OH)3]=1.0��10��38��Ksp [Mn(OH)2]=4.0��10��14
�ش��������⣺
��1�����������е�������1����MnO2���_____������������ˮ������HCl���____(���ѧʽ)��
��2�����̢���MnWO4���뷴Ӧ�Ļ�ѧ����ʽΪ______��FeWO4����ķ�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ___________��
��3����֪WO3(s)+3H2(g)=W(s)+3H2O(g) ��H=a kJ��mol��1
WO3(s)=WO3(g) ��H=b kJ��mol��1
д��WO3(g)��H2(g)��Ӧ����W(s)���Ȼ�ѧ����ʽ��_______��
��4�����̢���25��ʱ��pH������Ӧ����_______(������Ũ�ȵ���1.0��10��5mol��L��1ʱ������Ϊ���ѳ�����ȫ)��
��5�����̢�Ҫ���MnCl2���壬�ڼ���ʱ����ͬʱ��ȡ��һ���ʩ��__________��
��6��������ͭ��һ������ķǻ�ѧ�����Ȼ������ͨʽΪNaxWO3������0<x<1�����������������������ѧ���ʣ���һ�ֵ��³����塣Ӧ�ö��Ե缫������ڵ�Na2WO4��WO2���������Ʊ�������ͭ��д��WO42-�������Ϸŵ�ĵ缫��Ӧʽ��___________��
���𰸡�Fe2O3 Cl2 2MnWO4+2Na2CO3+O2![]() 2Na2WO4+2MnO2+2CO2 1:4 WO3(g)+3H2(g)=W(s)+3H2O(g) ��H=(a-b)kJ��mol-1 3.0 ͨ��HCl���壬��HCl�����м��� WO42-+xe-=WO3x-+O2-
2Na2WO4+2MnO2+2CO2 1:4 WO3(g)+3H2(g)=W(s)+3H2O(g) ��H=(a-b)kJ��mol-1 3.0 ͨ��HCl���壬��HCl�����м��� WO42-+xe-=WO3x-+O2-
��������
���۹�ҵ��������������ı仯������Ԫ�ػ��ϼ۵ı仯���ж����ʳɷ֣�����д��ѧ����ʽ�����ݸ�˹���ɣ�����֪�Ȼ�ѧ����ʽ����Ŀ���Ȼ�ѧ����ʽ�������ܶȻ���������������ȫ����ʱ��pH����ƽ���ƶ�ԭ����������ˮ��Ĵ�ʩ�����ݵ��ԭ��д�缫��Ӧʽ��
(1)������֪I���ͻ�ѧʽH2WO4��WO3֪�����ٿ�(FeWO4��MnWO4)��Fe��MnԪ�ؾ�Ϊ+2�ۣ��ڲ������зֱ𱻿�������ΪFe2O3��MnO2����������1����MnO2��Fe2O3��������1����Ũ���Ṳ��ʱ��MnO2��HCl��Ӧ����Cl2������Ũ����ӷ���HCl��ˮ������
(2)�Ӳ�������������Һ1���к���Na2WO4��������MnWO4��Mn��O2����ΪMnO2��WO42����Na2CO3����Na2WO4���ų�CO2���ɴ�д������ʽΪ2MnWO4+2Na2CO3+O2![]() 2Na2WO4+2MnO2+2CO2 ��FeWO4��O2����ΪFe2O3���ݻ��ϼ���������ȣ�����������O2���뻹ԭ����FeWO4�������ʵ���֮��Ϊ1:4��
2Na2WO4+2MnO2+2CO2 ��FeWO4��O2����ΪFe2O3���ݻ��ϼ���������ȣ�����������O2���뻹ԭ����FeWO4�������ʵ���֮��Ϊ1:4��
(3)�ݸ�˹���ɣ���������֪�Ȼ�ѧ����ʽ�������ȥWO3(s)�ɵ�Ŀ���Ȼ�ѧ����ʽWO3(g)+3H2(g)=W(s)+3H2O(g) ��H=(a-b)kJ��mol-1 ��
(4)������������Һ��������MnCl2��FeCl3������������pHʹFe3+��ȫ������Mn2+����������c(Fe3+)=1.0��10��5mol��L��1ʱ����Ksp[Fe(OH)3]=1.0��10��38 ��c(OH-)=1.0��10��11mol��L��1������c(H+)=1.0��10��3mol��L��1��pH=3��
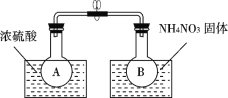
(5)������Ҫ��MnCl2��Һ�л��MnCl2���壬Ϊ����Mn2+ˮ�⣬����ͨ��HCl���塢����HCl�����м��ȡ�
(6)NaxWO3��������ΪWO3x-�����ڵ�Na2WO4��WO2���������Na+��WO42����W4+��O2����WO42���ڵ��������õ�������WO3x-���缫��ӦΪWO42-+xe-=WO3x-+O2- ��

����Ŀ������ʵ����̿��Դﵽʵ��Ŀ�ĵ���
��� | ʵ��Ŀ�� | ʵ����� |
A | ����0.100mol��L��1��ˮ | ����Ͳ��ȡ10.0mL5.00mol��L��1��ˮ���ձ��У�������������ˮϡ�ͣ�ת����500 mL����ƿ�ж��� |
B | ̽��SO2�Ļ�ԭ�� | ��ʢ��2mLH2S��Һ���Թ��л���ͨ��SO2���۲��Ƿ��г������� |
C | ��ȡ�������屽 | ��FeBr3��������������Br2�ı���Һ����ַ�Ӧ��ˮϴ��Na2SO3��Һϴ��ˮϴ����Һ�����Ȼ������ |
D | �Ƚ����ֺ�ɫ����FeS��CuS���ܶȻ� | �����ʵ���Ũ����ͬ��FeCl2��CuCl2�Ļ����Һ�в��ϼ���Na2S��Һ���۲������ɫ |
A. A B. B C. C D. D
����Ŀ����������ʵ���������ý�������ȷ����
ʵ�� | ʵ������ |
| ��Ʒ����Һ��ɫ��ȥ����������Һ�к���SO42- �ڼ�����ɫ�����Һ�����ڣ�δ����ɫ�ָ����������������ʹ��ɫʯ����ֽ��죬�����۵⻯����ֽ�������Ա仯�� |
A. Ʒ����Һ��ɫ����ˮƯ������
B. ����ƿ�з����˷�Ӧ��Cl2 + SO2 + 2H2O H2SO4 + 2HCl
C. ��������ڿ�ȷ������������ΪSO2
D. ����SO42-���Լ�Ϊ�����ᡢBaCl2��Һ