题目内容
【题目】下列解释事实或实验现象的化学用语正确的是
A. 硫酸酸化的KI淀粉溶液久置后变蓝:4I-+O2 + 4H+ ![]() 2I2+2H2O
2I2+2H2O
B. 铁和稀硝酸反应制得浅绿色溶液:Fe + 4H+ + NO3-![]() Fe3+ + NO↑+ 2H2O
Fe3+ + NO↑+ 2H2O
C. 水垢上滴入CH3COOH溶液有气泡产生:CaCO3+2H+ ![]() Ca2++CO2↑+ H2O
Ca2++CO2↑+ H2O
D. SO2通入漂白粉溶液中产生白色浑浊:SO2+Ca2++2ClO-+H2O ![]() CaSO3↓+2HClO
CaSO3↓+2HClO
【答案】A
【解析】
A.硫酸酸化的KI淀粉溶液久置后变蓝,二者发生氧化还原反应,离子方程式为:4I-+O2+4H+=2I2+2H2O,故A正确;
B.铁和稀硝酸反应产物与量有关,铁少量时变成三价铁,溶液由无色变为黄色,离子方程式为Fe + 4H+ + NO3-=Fe3+ + NO↑+ 2H2O;铁过量时变成二价亚铁,溶液由无色变为浅绿色,离子方程式为:3Fe + 8H+ + 2NO3-= 3Fe2+ +2 NO↑+ 4H2O,故B错误;
C.醋酸是弱酸,不能拆成离子,反应的离子方程式为:CaCO3+2CH3COOH═Ca2++H2O+CO2↑+2CH3COO-,故C错误;
D.SO2通入漂白粉溶液中产生白色浑浊:SO2+Ca2++2ClO-+H2O = CaSO3↓+2HClO,生成的次氯酸具有强氧化性,能氧化亚硫酸钙,故D错误。答案选A。

【题目】四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素 | A | B | C | D |
性质结构信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)写出B原子的电子排布式__________
(2)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为__________,简要描述该配合物中化学键的成键情况:__________
(3)“。”表示氢原子,小黑点“·”表示没有形成共价键的最外层电子,短线表示共价键。

则在以上分子中,中心原子采用sp3杂化形成化学键的是__________(填序号);在②的分子中有__________个σ键和__________个π键
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:
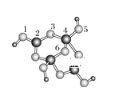
在Xm-中,硼原子轨道的杂化类型有__________;配位键存在于__________原子之间(填原子的数字标号);m=__________(填数字)
(5)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀;在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,则第一种配合物的化学式为__________,第二种配合物的化学式为_________ .