题目内容
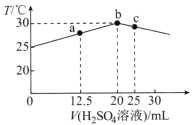
【题目】25℃时,向盛有25mLpH=12的一元碱MOH溶液的绝热容器中滴加0.05mol·L-1H2SO4溶液,加入H2SO4溶液的体积(V)与所得混合溶液温度(T)的关系如图所示。下列说法正确的是( )
A.应选用酚酞作指示剂
B.a点溶液中存在:c(MOH)+c(M+)<4c(SO![]() )
)
C.水的电离程度:a<b<c
D.b→c的过程中,温度降低的主要原因是溶液中发生了吸热反应
【答案】B
【解析】
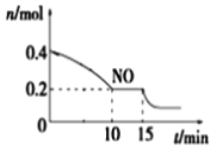
根据图象可知,b点温度最高,说明b点MOH和硫酸恰好反应,25mLpH=12的一元碱MOH溶液与20mL 0.05mol·L-1H2SO4溶液恰好反应,MOH的浓度是0.08 mol·L-1,所以MOH是弱碱。
A. MOH是弱碱,和硫酸恰好反应时,溶液呈酸性,应选用甲基橙作指示剂,故A错误;
B.根据物料守恒, a点溶液中M元素的物质的量是0.08 mol·L-1×0.025L=0.002mol,SO![]() 的物质的量是0.05mol·L-1×0.0125L=0.000625mol,所以存在:c(MOH)+c(M+)<4c(SO
的物质的量是0.05mol·L-1×0.0125L=0.000625mol,所以存在:c(MOH)+c(M+)<4c(SO![]() ),故B正确;
),故B正确;
C. b点MOH和硫酸恰好反应,溶质为M2SO4,a点碱有剩余、c点酸有剩余,所以水的电离程度b最大,故C错误;
D. b点MOH完全消耗,b→c的过程中,不再发生反应,加入硫酸的温度低于混合液的温度,所以溶液温度降低,故D错误;
选B。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
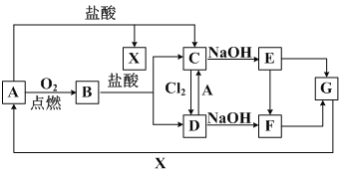
能考试全能100分系列答案【题目】实验室用如图所示装置制备氯气并进行一系列相关实验(夹持设备及必要的加热装置已省略)。
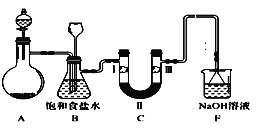
(1)整套装置装配完毕后,首先进行的操作是___,再添加试剂。
(2)实验室常用MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O制取氯气:
MnCl2+Cl2↑+2H2O制取氯气:
①实验时,通常采用密度为1.19g/cm3、浓度为36.5%的浓盐酸。该浓盐酸的物质的量浓度为____。
②标准状况下,上述反应每生成4.48L氯气,转移电子的物质的量为___mol。
(3)洗气装置B的作用是除去Cl2中的HCl气体,同时用作安全瓶(监测实验时装置C中是否发生堵塞)。若装置C发生堵塞,装置B中将观察到的现象是___。
(4)装置C的作用是验证氯气是否具有漂白性。为此,实验时装置C中I、II、III处依次放入的物质是____(填字母)。
A | B | C | D | |
I | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 无水氯化钙 | 无水氯化钙 | 浓硫酸 |
III | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
(5)向品红溶液中同时通入氯气和二氧化硫(按物质的量之比1:1),观察到的现象是___。用化学方程式解释一下原因___。
(6)F为尾气吸收装置。实验时,该装置中反应的离子方程式___。