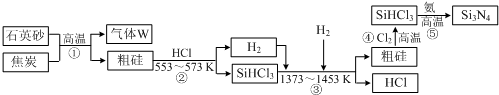
题目内容
20.将一定量的锌粒与200mL某浓度的盐酸完全反应,生成5.6L H2(标准状况).(1)写出该反应的化学方程式Zn+2HCl═ZnCl2+H2↑;
(2)计算该盐酸中HCl的物质的量浓度.
分析 (1)发生反应:Zn+2HCl═ZnCl2+H2↑;
(2)计算氢气的物质的量,再根据方程式计算HCl的物质的量,根据c=$\frac{n}{V}$计算盐酸的物质的量浓度.
解答 解:(1)Zn与盐酸反应方程式为:Zn+2HCl═ZnCl2+H2↑,
故答案为:Zn+2HCl═ZnCl2+H2↑;
(2)5.6L 氢气的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,根据方程式:Zn+2HCl═ZnCl2+H2↑,可知HCl的物质的量为0.25mol×2=0.5mol,则盐酸的物质的量浓度为$\frac{0.25mol}{0.2L}$=1.25mol/L,
答:盐酸的物质的量浓度为1.25mol/L.
点评 本题考查化学方程式的有关计算,比较基础,有利于基础知识的巩固.

练习册系列答案
相关题目
11.次磷酸盐可用于化学镀,向盛有次磷酸钠和氢氧化钠混合溶液的铁质容器中加入硫酸铜溶液,容器内壁形成牢固的铜镀层,其原理为H2PO2-+Cu2++X-→PO43-+Cu+H2O(未配平),下列有关说法正确的是( )
| A. | 该反应中次磷酸根离子得电子,表现还原性 | |
| B. | 该反应中氧化剂与还原剂的物质的量之比为1:1 | |
| C. | 该反应每消耗3 molX,转移电子的物质的量为2mol | |
| D. | 若将硫酸铜溶液换成硝酸银溶液,容器内壁不会形成镀层 |
8.下列实验设计正确的是( )
| A. | SO2中混有CO2,通入饱和NaHSO3溶液,除CO2 | |
| B. | NaCl溶液中混有NaAlO2,通入适量CO2以将Al元素转化为Al(OH)3沉淀,过滤即可 | |
| C. | 欲制备FeCl2固体,可将过量的铁粉在少量氯气中燃烧的方式获得 | |
| D. | 除去SiO2中的Al2O3,加稍过量的稀盐酸,过滤、洗涤、干燥即可 |
15.下列各组物质中互为同系物的是 ( )
| A. | 甲醇、乙二醇 | B. | 丙三醇、乙二醇 | C. | 甲醚、乙醇 | D. | 甲醇、2-丙醇 |
5.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 能使甲基橙变红的溶液中:Na+、Fe2+、SO42-、MnO4- | |
| B. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:K+、Na+、Cl-、HCO3- | |
| C. | 0.1 mol•L-1的NH4I溶液中:Mg2+、Na+、ClO-、NO3- | |
| D. | 0.1 mol•L-1的CuSO4溶液中:Mg2+、Al3+、Br-、Cl- |
12.芫荽酮B的结构简式如图所示,下列有关该化合物的说法不正确的是( )
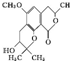

| A. | 每个分子中有2个手性碳原子 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1 mol该物质最多可与含2 mol NaOH的水溶液反应 | |
| D. | 分子中有3种含氧官能团 |
9.烧杯中盛放浓度均为0.10mol/L,氯化钠和硝酸铜的混合溶液,现将该溶液以惰性电极电解,当铜离子全部在阴极下转为金属铜时,溶液的pH值为( )
| A. | 7.00 | B. | 1.00 | C. | 0.7 | D. | 1.30 |
10.25℃、101kPa下,二氧化碳和过氧化钠反应后,若固体质量增加了14g,反应中有关物质的物理量正确的是( )
| O2 | Na2CO3 | CO2 | 转移电子数 | |
| A | 1mol | 0.5NA | ||
| B | 0.5mol | 11.2L | ||
| C | 0.25mol | 53g | ||
| D | 8g | NA |
| A. | A | B. | B | C. | C | D. | D |